В текущем 2019 году Нобелевской премии в области физиологии и медицины удостоены американцы William G.Kaelin Jr (Уильям Кэлин) и Gregg L.Semenza (Грегг Семенза), британец Sir Peter J.Ratcliffe (Питер Рэтклифф) за изучения механизма реакции клеток на гипоксию.
Согласно формулировке Нобелевского комитета, лауреаты отмечены «за открытие механизмов, посредством которых клетки воспринимают доступность кислорода и адаптируются к ней».

Вручение Нобелевской премии и лекция нобелевских лауреатов состоится 07 Декабря 2019 года в Каролинском университете (США).
Первоначальной моделью для изучения механизма реакции клеток на гипоксию стала регуляция гена эритропоэтина в клетках почек или печени. За десяток лет выяснились основные этапы этой регуляции, общая схема которой приведена на рис. 2.
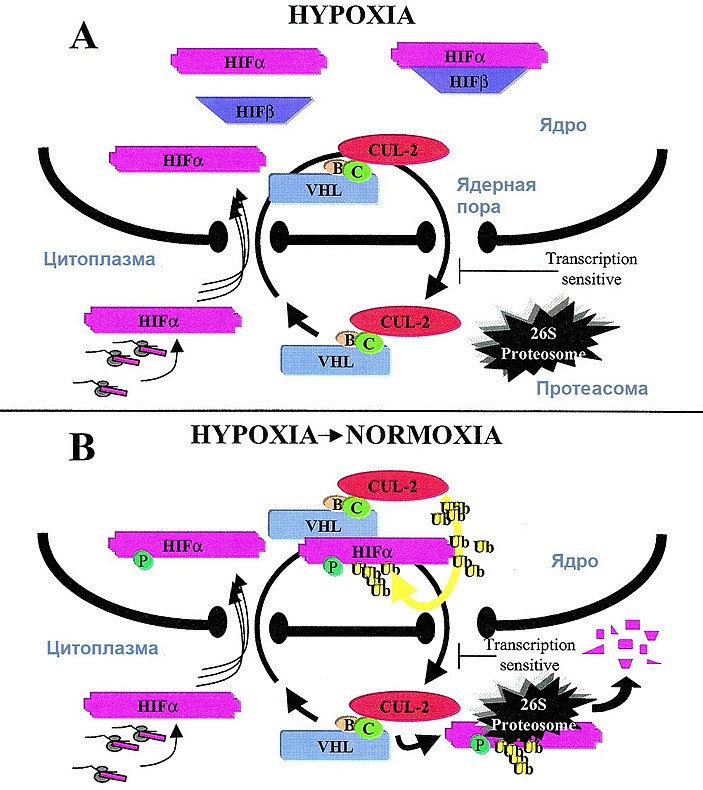
В 1991 году Sir Peter J.Ratcliffe в своих исследованиях обнаружил около 3'-концевого участка гена эритропоэтина регуляторный участок (энхансер), присутствие которого определяет способность гена повышать уровень экспрессии при дефиците кислорода (C. W. Pugh et al., 1991. Functional analysis of an oxygen-regulated transcriptional enhancer lying 3' to the mouse erythropoietin gene). Годом позже в лаборатории, где работал Грегг Семенза был выделен и исследован транскрипционный фактор, связывающийся с ДНК в этой области, — он получил название HIF (G. L. Semenza, G. L. Wang, 1992. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation). Этот белок формируется из двух субъединиц: одна из них обозначается как HIFα, другая — HIFβ. Вскоре было установлено, что HIF работает не только в почках и печени, но и во всех прочих типах клеток организма (G. L. Wang, G. L. Semenza, 1993. General involvement of hypoxia-inducible factor 1 in transcriptional response to hypoxia).
Здесь можно отметить, что у человека и других позвоночных обе субъединицы фактора HIF представлены семействами, включающими по 3 паралогичных гена, которые работают в разных типах клеток и регулируют разные наборы генов. Причем белковый продукт гена HIF3α, по-видимому, является ингибитором по отношению к продукту гена HIF1α. Тонкости функциональных особенностей всех паралогов все еще не до конца изучены.
Количество мРНК и белка HIFβ в клетках относительно постоянно, оно не зависит от концентрации кислорода, а вот субъединица HIFα является регулируемой. Во-первых, ее количество в клетке держится на низком уровне при нормальном уровне кислорода, но резко возрастает при гипоксии. Во-вторых, при гипоксии он обнаруживается исключительно в ядре, а при нормальном уровне кислорода — преимущественно в цитоплазме, что обеспечивается взаимодействием белка с вспомогательными белками системы переноса белков между ядром и цитоплазмой.
Исследования William G.Kaelin Jr позволили выяснить, что количество белка HIFα регулируется посредством протеолиза — разрушения при помощи протеасом (M. Ivan et al., 2001. HIFα Targeted for VHL-Mediated Destruction by Proline Hydroxylation: Implications for O2 Sensing). Протеасомы узнают белки-мишени по пришитым убиквитиновым меткам. В случае HIFα убиквитинирование осуществляется при участии того самого белка VHL, который уже упоминался выше. Ген, кодирующий белок VHL, входит в число наиважнейших генов-супрессоров опухолей. И это, по-видимому, напрямую связано с его ролью в регуляции HIF — как минимум, отчасти (W. G. Kaelin, 2005. The von Hippel-Lindau tumor suppressor protein: roles in cancer and oxygen sensing, K. Kondo et al., 2003. Inhibition of HIF2α Is Sufficient to Suppress pVHL-Defective Tumor Growth).
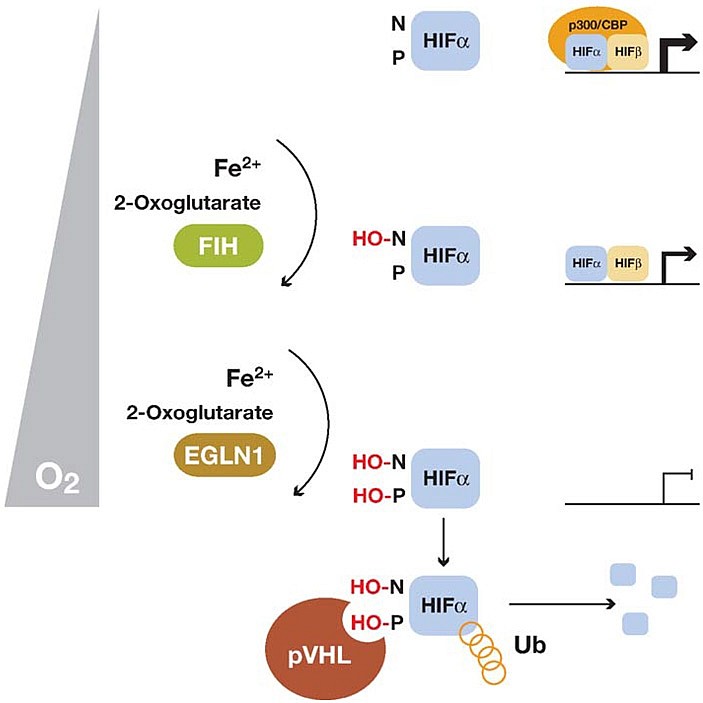
Позднее были установлены новые подробности. Оказалось, что для взаимодействия с VHL требуется появление гидроксильных групп (-OH) на двух остатках пролинав молекуле HIFα. Гидроксилирование осуществляется ферментами PHD (Prolil hydroxylase), которые кодируются тремя паралогичными генами (PHD1,2,3). Эта реакция происходит при непосредственном участии молекулярного кислорода (O2), а также требует присутствия ионов железа и аскорбиновой кислоты. При недостатке какого-то из этих компонентов реакция гидроксилирования становится невозможной, что приводит к прекращению взаимодействия HIFα с VHL, и количество белка HIFα начинает расти.
Еще одной составляющей изученного механизма оказалось гидроксилирование по остатку аспарагина в молекуле HIFα, которое осуществляется (при тех же условиях, что и гидроксилирование по пролину) другим ферментом, названным FIH1 (Factor inhibiting HIF). Гидроксилирование остатка аспарагина препятствует взаимодействию HIFα с транскрипционным коактиватором (CBP или p300), без которого уровень активации транскрипции генов-мишеней оказывается заметно ниже.
Аспарагин-гидроксилаза и пролин-гидроксилазы имеют разный порог активации. Полномасштабный ответ на гипоксию развивается при парциальном давлении кислорода около 1% от нормы или ниже. При этой концентрации гидроксилазы абсолютно неактивны. По мере повышения концентрации кислорода после гипоксии первым активируется белок FIH-1, который гидроксилирует остатки аспарагина, приводя к частичному подавлению активаторной функции HIF, а при дальнейшем приближении концентрации кислорода к нормальному уровню становится активной и диоксигеназа PHD, гидроксилирующая остатки пролина, и концентрация HIFα начинает быстро снижаться (рис. 3).
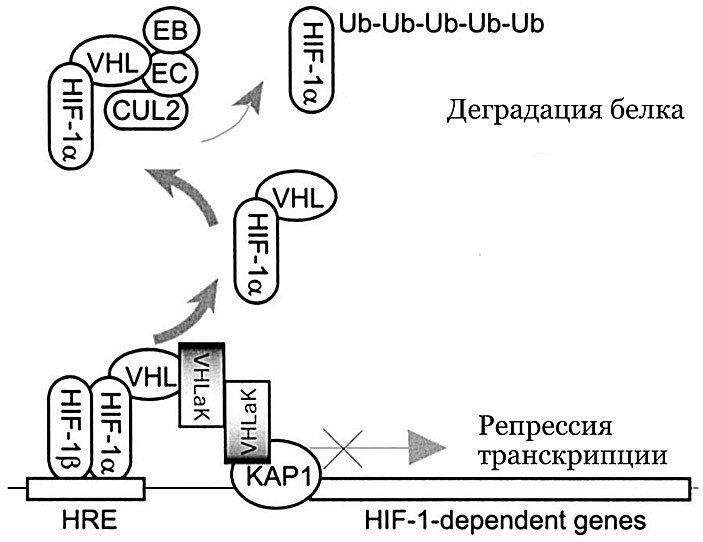
Позже оказалось, что помимо убиквитинирования, VHL способен блокировать работу HIF еще и другим путем — привлекая к нему белки-репрессоры, препятствующие активации транскрипции генов-мишеней, как показано на рис. 4.
Регуляция с участием HIF затрагивает в сумме более трех сотен генов, функция которых заключается в обеспечении снабжения тканей кислородом, стимулировании регенеративных процессов и включении защитных механизмов внутри клеток, подвергшихся воздействию гипоксии (J. Schödel et al., 2011. High-resolution genome-wide mapping of HIF-binding sites by ChIP-seq).
Например, одной из таких защитных реакций является повышение интенсивности реакций гликолиза (расщепления глюкозы до молочной кислоты в цитозоле клеток), как альтернативного пути наработки АТФ (в обычных условиях основная доля АТФ производится за счет кислородного дыхания, осуществляемого митохондриями). Также гипоксия стимулирует аутофагию, и одновременно подавляет некоторые особенно энергозатратные процессы. На уровне межтканевой регуляции происходит стимуляция не только эритропоэза, но и ангиогенеза (роста сосудов) — благодаря стимуляции синтеза и секреции фактора роста эндотелия сосудов VEGF, расширения капилляров, интенсивности вентиляции легких и целого ряда других физиологических процессов. В нервной ткани обнаружилась выраженная реакция на колебания снабжения мозга кислородом в клетках астроцитах. Оказалось, что выделяемый ими эритропоэтин не только участвует в активации эритропоэза, но и стимулирует миграцию нейробластов в область ишемического повреждения мозга, то есть регенерацию нервной ткани (J. C. Chavez et al., 2006. The Transcriptional Activator Hypoxia Inducible Factor 2 (HIF-2/EPAS-1) Regulates the Oxygen-Dependent Expression of Erythropoietin in Cortical Astrocytes).
Вся система реакций на уровне молекул, клеток и организма включает множественные взаимовлияния, как положительные, так и отрицательные, формирующие разнообразные обратные связи (рис. 5). Весьма примечательно, что в число генов, активируемых фактором HIF, входят гены ферментов гидроксилаз, которые в конечном итоге ограничивают реализацию ответа на гипоксию.
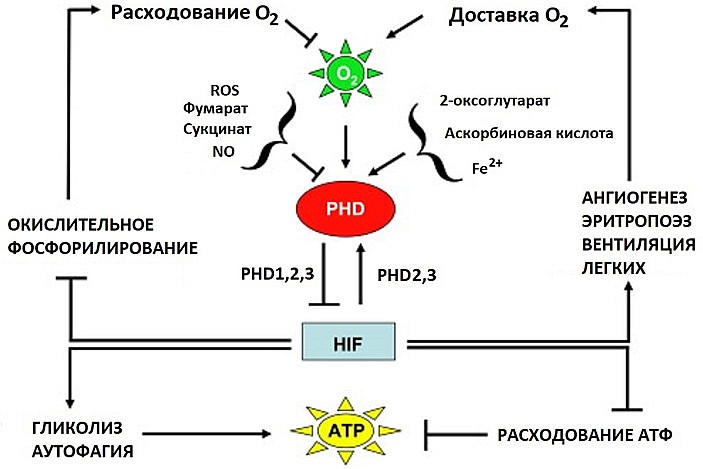
А при чрезмерно затянувшемся состоянии гипоксии к регуляции подключается p53 — еще один известный супрессор опухолей. В комплексе с белком Mdm2, он связывает HIFα, что приводит опять же к убиквитинированию и протеасомной деградации этого белка. К тому же белок p53 конкурирует c HIF за связывание коактиваторных белков CBP/p300.
Гипоксия, HIF и медицинская практика
Все многоклеточные организмы, а животные в особенности, чрезвычайно зависимы от кислорода. Этот элемент совершенно необходим нам для дыхания — процесса, который обеспечивает производство в митохондриях молекул АТФ, используемых практически во всех процессах жизнедеятельности клеток. Неудивительно, что целый ряд медицинских проблем связан именно с нарушениями снабжения тканей кислородом и ответом на это состояние. Это определяет тесную связь фундаментальной составляющей сделанных открытий с медицинской практикой.
Во-первых, потенциальное практическое применение связано с проблемой адаптации организма к каким-то специфическим условиям, где по той или иной причине возникает более или менее длительная кислородная недостаточность — подъем на высоту, подводные погружения и т. д. Во-вторых, — с лечением нарушений в тканях, обусловленных ишемическими состояниями, к примеру, из-за атеросклеротических изменений сосудов, гипертонии, заболеваний дыхательных путей или анемии. В-третьих, — с воспалительными процессами, включая, в частности, заживление ран и отторжение трансплантатов. В-четвертых, оно связано с проблемой возрастных изменений, которые могут выражаться в неспособности организма в полной мере реализовать необходимый адаптивный ответ на гипоксию тканей.
Все вышеупомянутые проблемы могут иметь решение в виде дополнительной активации ответа организма на гипоксию. Для этого разрабатываются препараты, ингибирующие белки гидроксилазы и VHL. В частности, в настоящее время для лечения анемии испытывается препарат Роксадустат (Roxadustat), который ингибирует ферменты PHD (пролилгидроксилазы).
С другой стороны, HIF очень часто бывает гиперактивирован в опухолевой ткани. Эта повышенная активность бывает обусловлена как фактическим недостатком доступа кислорода к клеткам опухоли вследствие очень быстрого ее роста, так и мутациями в гене белка HIFα или его регуляторов. В этом случае потенциально возможным решением является, напротив, применение подавителей ответа на гипоксию, которые препятствуют интенсивному ангиогенезу в опухолевой ткани и тем самым замедляют рост и понижают агрессивность раковой опухоли. Некоторые синтетические препараты, прямо или косвенно подавляющие HIF (например, сердечный гликозид дигоксин), в настоящее время проходят клинические испытания для лечении нескольких форм рака.
О проонкогенном влиянии избыточной активации HIF, конечно, следует помнить, разрабатывая стратегии решения проблем гипоксии, упомянутые чуть выше. Гиперактивация ответа на гипоксию может иметь и другие негативные последствия.
Наконец, нельзя не сказать о том, что система ответа на концентрацию кислорода оказывается критически важной не только в каких-то специфических условиях среды или при патологии тканей, но и в ходе нормального эмбрионального развития. HIF участвует в росте, дифференцировке, контроле апоптоза клеток многих тканей, включая сердечно-сосудистую, скелетогенную и иммунную системы. Эксперименты на животных показали, что эмбрион, лишенный функционального фактора HIF, очень рано погибает вследствие нарушения процессов формирования кровеносной системы по мере роста зародыша и невозможности нормального развития организма.
В последние годы становится ясно, что реакции клеток на изменения доступности кислорода достаточно многокомпонентны и что есть и другие сигнальные пути, не включающие HIF. И трое ученых, удостоенных Нобелевской премии, как и сотни других исследователей по всему миру, продолжают активно развивать данную область. С этими новыми подробностями можно познакомиться в совсем недавних публикациях, напримеру: M. Ivan, W. G. Kaelin, 2017. The EGLN-HIF O2-Sensing System: Multiple Inputs and Feedbacks, A. A. Chakraborty et al., 2019. Histone demethylase KDM6A directly senses oxygen to control chromatin and cell fate и C. W. Pugh, P. J. Ratcliffe, 2017. New horizons in hypoxia signaling pathways. И есть все основания ожидать, что эти исследования сыграют важную роль в решении практических задач здравоохранения.
Татьяна Романовская (https://elementy.ru/)
Купить расходные материалы для КИСЛОРОДНОЙ ТЕРАПИИ вы можете на сайте ARTMED.STORE






467 комментариев
P.S Live ID: K89Io9blWX1UfZWv3ajv
P.S.S <a href=https://ludii.games/forum/showthread.php?tid=2146>Программы и игры для Андроид телефона</a> 7ef476c
Thank you! Plenty of forum posts.
Casino online mr bet [url=https://jcsustem.com/review-betwhale/]betwhale casino[/url] fastest withdrawal online casino usa.
Online casino in sri lanka [url=https://serintcomp.com/review-7bit/]casino 7bit[/url] us online casino real money.
Agen casino dadu online [url=https://serintcomp.com/credit-card-casino/]credit card casino[/url] casino royale online streaming free.
Best rated online casinos uk [url=https://jcsustem.com/online-casino-real-money/]casino online[/url] merkur casino spiele online!
Odawa online casino [url=https://serintcomp.com/review-slotocash/]slotocash casino[/url] free bonus online casino no deposit.
http://jylgaskin.com/?p=38&unapproved=16360&moderation-hash=bdfd2bce267a2dfcd6341e83884e1f69#comment-16360
https://blog.my-mooc.com/zoom-sur-le-mooc-concevoir-et-diriger-un-projet-de-spectacle/?unapproved=293281&moderation-hash=a92478f02d8e57fa37d7665e419b1905#comment-293281
https://www.feezital.com/blog/5-ways-to-style-up-for-your-friends-wedding/?unapproved=68273&moderation-hash=8dff51e19506ac500cc62e3722981500#comment-68273
https://xn----7sbbrc6a3acms7c6c6a.xn--p1ai/online/?unapproved=69843&moderation-hash=48aaa098d16b2941bee6a59b04d0fc23#comment-69843
http://squadcraft.net/threads/top-legit-online-casinos-l602sm.25533/
Nicely put, Regards.
Best apps for online casino [url=https://seodoorgen.com/review-mybookie/]mybookie sportsbook[/url] 1 deposit online casino usa!
Play online casino in singapore [url=https://geek-hub.dev/online-slots/]https://geek-hub.dev/online-slots/[/url] golden nugget online casino no deposit bonus!
New online zar casinos [url=https://py-hub.com/cricket-betting/]online cricket betting[/url] best barcrest online casino!
South african online casinos list [url=https://serintcomp.com/online-casino-games/]casino games online[/url] real online casino win real money!
Omni online casino [url=https://seodoorgen.com/legit-casinos/]legit casino online[/url] what online casino accept paysafecard.
https://forum.graylite.com/viewtopic.php?t=144324
http://www.comrades-horde.ru/forums/viewtopic.php?f=18&t=322150
http://griffhunter.com/boards/viewtopic.php?p=859796#p859796
http://moujmasti.com/showthread.php?586874-5-well-liked-online-casino-hideaway-games-o33fxi&p=1370213#post1370213
http://forum.vbalkhashe.kz/showthread.php?tid=81300
Wonderful forum posts. Many thanks!
Silveredge casino online real money [url=https://serintcomp.com/new-online-casinos/]https://serintcomp.com/new-online-casinos/[/url] betrivers casino online.
Brand new online casino no deposit bonus [url=https://jcsustem.com/review-betwhale/]betwhale sportsbook[/url] free spin online casino!
Reload bonus online casino [url=https://clemsonrf.com/sports-gambling-apps/]gambling apps[/url] online ideal casino!
Hollywood casino online gambling [url=https://seodoorgen.com/online-omaha-poker/]play omaha online[/url] online casino 500 bonus.
Turningstone online casino [url=https://jcsustem.com/omaha-poker-online/]omaha poker online[/url] wyoming online casinos.
http://toshibow.com/cgi-bin/kb1/kb.cgi
https://www.mmopro.org/introductions/132409-online-casino-nederland-h53sow.html#post186066
https://elitetutoring.ca/back-to-school-tutoring-as-a-proactive-tool/#comment-64285
https://www.artpontodecor.com.br/2018/07/05/decorando-sua-casa-com-espelhos/?unapproved=470289&moderation-hash=291050b156c79071c659ca017e3e9878#comment-470289
http://www.pc2163.com/viewtopic.php?p=1448311#p1448311
Online casino lawyers http://rudavision.com/bbs/board.php?bo_table=free&wr_id=763553 best free bonus online casino!
Sizzling hot deluxe real money play at online casino https://kr.meyer.com/bbs/board.php?bo_table=free&wr_id=219705 top 5 most trusted online casinos!
Bovegas online casino no deposit bonus codes https://funsilo.date/wiki/User:WaldoBelue2 partycasino online casinos!
Online casino fast cashout http://aanline.com/eng/board/bbs/board.php?bo_table=free&wr_id=247530 beste online lotto casinos!
Online casino grand mondial https://chessdatabase.science/wiki/The_Secret_Of_Best_Online_Casino_Real_Money_No_Deposit goldfish casino online.
https://ng.nycc.org/content/furosemide-want-purchase?page=4823#comment-391152
http://imagenschool.com/revision-de-sony-fe-24-50-mm-f2-8-g-una-delicia-reducida-o-se-queda-corta/?unapproved=8114&moderation-hash=3575ad688c720b7e5f4ff7f8c6fbf671#comment-8114
https://39504.org/showthread.php?tid=34451&pid=377970#pid377970
http://www.ilove-meso.com/cgi-bin/mesobbs.cgi
https://www.forum-joyingauto.com/showthread.php?tid=144198
With thanks! I like this!
Asgards thunder online casino http://sr.yedamdental.co.kr/bbs/board.php?bo_table=free&wr_id=1683415 online az casino.
Sichere online casinos https://maille-space.fr/author/lilianamccu/ gta online how to enter casino!
Top online casino sites nz https://mediawiki.aqotec.com/index.php/Five_Predictions_On_Casino_Games_Online_In_2025 safe online casinos.
Agen judi casino joker123 online https://www.how2youtube.com/g/bbs/board.php?bo_table=free&wr_id=1987557 do online casinos cheat roulette.
Bandar betting casino dadu online https://opensourcebridge.science/wiki/User:EmeryKavanagh free online casino bonus slot machines!
https://orpiment.xyz/thread-78219.html
http://gamesection.free.fr/phpbb/viewtopic.php?f=2&t=10816
https://oke.zone/viewtopic.php?pid=1346338#p1346338
http://t20suzuki.com/phpBB2/viewtopic.php?p=1267528#1267528
http://124.mannlist.com/viewtopic.php?t=55357405
Appreciate it! A good amount of posts!
Online casinos that pay real money instantly http://old.remain.co.kr/bbs/board.php?bo_table=free&wr_id=3095949 online casino australia free signup bonus!
What is a good online casino http://www.itranslate.co.kr/bbs/board.php?bo_table=free&wr_id=2231473 3d artist casino online.
32red online casinos https://yy2.net/space-uid-7166.html?do=profile list of online casinos in australia.
Online casino money no deposit http://www.hptech.co.kr/bbs/board.php?bo_table=04_order&wr_id=140291 pennsylvania online casino bonuses.
Online casino coins https://ceshi.xyhero.com/home.php?mod=space&uid=3049401&do=profile&from=space myanmar online casino game.
http://matsuno.tv/yybbs/yybbs.cgi
http://wiseturtle.razornetwork.com/viewtopic.php?p=216279#p216279
http://rollerderbybordeaux.fr/forum/viewtopic.php?f=23&t=4547
http://chineseinirvine.com/viewtopic.php?p=102955#p102955
https://bbs.sinbadgroup.org/index.php?xjkh-tampa-s-poster-pup-for-new-cancer-treatment.t48661.html/page-6482#post-278692
Is it very hard to set up your own blog? I'm not very techincal but I can figure things out pretty fast.
I'm thinking about setting up my own but I'm not sure where
to start. Do you have any points or suggestions?
Thank you
your time just for this fantastic read!! I definitely appreciated every bit of it and I have
you book-marked to see new stuff in your web site.
Моды для игр дают невероятную свободу в игре, что делает процесс гораздо увлекательнее. Играя с модификациями, я могу создать новый игровой процесс, что добавляет новые приключения и делает игру более достойной внимания.
Это действительно невероятно, как такие моды могут улучшить игровой процесс, а при этом не нарушая использовать такие взломанные версии можно без особых проблем, если быть внимательным и следить за обновлениями. Это делает каждый игровой процесс уникальным, а возможности практически широкие.
Советую попробовать такие модифицированные версии для Android — это может переведет ваш опыт на новый уровень
Моды для игр дают невероятную свободу в игре, что взаимодействие с игрой гораздо красочнее. Играя с модификациями, я могу повысить уровень сложности, что добавляет новые приключения и делает игру более непредсказуемой.
Это действительно интересно, как такие модификации могут улучшить игровой процесс, а при этом не нарушая использовать такие взломанные версии можно без особых проблем, если быть внимательным и следить за обновлениями. Это делает каждый игровой процесс персонализированным, а возможности практически широкие.
Рекомендую попробовать такие игры с модами для Android — это может придаст новый смысл
Over the years, Plinko has developed from a television game show segment into a full-fledged casino attraction, with virtual casinos offering their own online renditions. The beginnings of Plinko can be traced back to its initial introduction on the U.S. television competition The Price Is Right. Premiered in the eighties, the game rapidly turned into a fan favorite due to its entertaining structure and unpredictable outcomes.
Website: https://india-plinko.web.app/
Contestants would place a small playing token, referred to as the Plinko piece, from the starting position. As it made its way down, the disc would strike various deflectors in a random pattern before ending up at one of several slots at the bottom, each offering a different payout amount.
skilled users may prolong this period. However, longer cycles
must be tried with warning, as they might put the
body under further strain. Listening to your body’s
feedback is critical and can guide any required modifications to your chopping cycle.
As a first-time Anavar user, developing a structured meal plan and exercise
routine is pivotal in attaining optimum outcomes.
A balanced food plan, paired with consistent and difficult exercise sessions,
enhances the impact of the cycle, resulting in significant muscle development and power
improvement. It’s essential to learn from the experience and make knowledgeable selections by
fastidiously observing and assessing the impression of Anavar utilization. A beginner Anavar cycle often lasts between six to eight weeks.
A woman ought to discontinue her cycle if she begins
to expertise any undesirable symptoms. Prolonged Anavar use can result in cardiovascular problems,
liver damage, hormone suppression, and psychological points.
Males might experience gynecomastia and sexual dysfunction, while girls risk irreversible virilization effects.
If you experience any concerning unwanted effects,
it’s important to hunt medical assist right away.
It could additionally be a good idea to slow down, change
the dosage, or simply stop using Anavar altogether. At Asana Restoration, we perceive that these
choices may be overwhelming. We provide compassionate care and steerage that can assist you make one of
the best selections.
In Style stacks include combining Anavar with testosterone for balanced results whereas managing potential dangers.
It Is particularly good for slicing cycles, aiming for lean muscle whereas shedding fat.
Anavar stays a top choice for these looking for fats loss, lean muscle
retention, and a cleaner physique with fewer unwanted effects.
When ladies take Anavar at 10 mg per day, we frequently see them experience muscle
features throughout the first 10 days. A woman taking 10 mg of Anavar per day has a extra highly effective
effect than a person taking 20 mg of Anavar per day. This
is because of men producing roughly 20x more testosterone in comparison with girls (30).
When Anavar (oxandrolone) was first produced, it was legal to purchase for bodybuilding functions.
Whereas in-network providers can provide extra inexpensive care and higher protection, sometimes you could have
no selection however to hunt services from an out-of-network provider.
Out-of-network suppliers can embody doctors, hospitals, labs, and other types of healthcare professionals.
When you obtain companies from these suppliers, they'll invoice your insurance coverage firm for their providers at their own rates.
A normal initial dosage can vary between 30 to 50 milligrams daily, depending on components like weight and daily activity degree.
By starting on the decrease end of this range, the consumer can gauge their body’s response
and successfully monitor any unwanted facet effects.
During this period, it’s essential to focus on signs which will indicate the need for a dose adjustment.
If a user has no preference and equally wants to construct muscle and burn fats on the identical time, maintenance calories may be optimal.
Calorie consumption ought to be tailor-made to a user’s aims when cycling Anavar.
Subsequently, if Anavar is taken with the intention of bulking and
gaining lean mass, then a small calorie surplus may be adopted to reinforce
muscle and power outcomes. We find that Anavar users can drink small amounts of alcohol and never experience any important hepatic points.
This is due to Anavar being metabolized by the kidneys, thus inflicting less stress to the liver.
Ваш курьер был так внимателен, будто доставлял семейную реликвию!
<a href=https://cvety2tomsk70.ru/>цветы</a>
Цветы по мотивам картины Ван Гога - живое искусство!
<a href=https://cvety1tomsk70.ru/>букет невесты</a>
Розы с доставкой в ресторан - создали идеальную атмосферу!
<a href=https://severussnape.borda.ru/?1-1-0-00000228-000-0-0-1754294976>купить 101 розу в томске</a>
Подарочная упаковка - просто класс!
<a href=https://superogorod.ucoz.org/forum/2-3992-1>купить цветы томск</a>
Доставили на работу - коллеги завидовали такому красивому букету!
<a href=https://automobilist.forum24.ru/?1-5-0-00001594-000-0-0-1752487432>доставка цветов в томске</a>
Цветы доставили в другой город - приехали свежими, как с клумбы!
<a href=https://dostavkacvetovtomsk1.ru/>заказать цветы томск</a>
Подарочный сертификат в дизайнерском конверте - удобно и стильно!
<a href=https://cvety1tomsk70.ru/>доставка цветов в томске</a>
Помогли определиться в море вариантов - спасибо!
<a href=http://dostavkacvetovtomsk70.ru>розы купить в томске</a>
https://pin-it.space/item/450135 wehrle
https://www.google.com.ag/url?q=https://wehrle.de/wp-content/pgs/hgh_kaufen_2.html wehrle
https://apunto.it/user/profile/111684 hgh bodybuilding cycle
https://firsturl.de/iE849p8 Hgh Fat Loss Dosage
http://celebratebro.in/birthdays-in-bangalore/index.php?qa=user&qa_1=wheelquiver00 how much iu of hgh should i take a day
https://xn---6-jlc6c.xn--p1ai/user/plowtheory33/ 3 month hgh before and after
https://www.google.fm/url?q=https://wehrle.de/wp-content/pgs/hgh_kaufen_2.html wehrle
https://xn---6-jlc6c.xn--p1ai/user/plowtheory33/ hgh x2 review
https://eskisehiruroloji.com/sss/index.php?qa=user&qa_1=celerybreak97 Hgh Dose For
Muscle Growth
http://uznew.uz/user/womeneye77/ benefits of hgh bodybuilding
https://techniknews.top/item/450354 testosterone and hgh cycle
https://medknigki-v-ulan-ude.ru/user/celerysmile83/ hgh steroid
cycles
https://support.mikrodev.com/index.php?qa=user&qa_1=celerypeen79 hgh-x2 de crazybulk y
genf20
https://images.google.com.na/url?q=https://wehrle.de/wp-content/pgs/hgh_kaufen_2.html 2 Iu hgh
fettverbrennung
https://maps.google.fr/url?q=https://wehrle.de/wp-content/pgs/hgh_kaufen_2.html wehrle
https://rentry.co/3ebkqwqs hgh cycles
https://www.metooo.io/u/68a5af778c76943744dc3d31 wehrle
https://buketik39.ru/user/kendosoda79/ difference between testosterone
and hgh
https://xn--ciqaa.online/deenumbers9289 wehrle
https://www.fightdynasty.com/companies/kaufen-genopharm-hgh-somatropin/ hgh dose
https://cloudcrunch.com/employer/human-growth-hormone-hgh-vorteile-verwendungen-und-nebenwirkungen/ is hgh better than testosterone
https://quaillink.com/nicolewentwort 4iu hgh reddit
https://futureblazr.com/employer/hgh-kaufen-legal-und-sicher-so-gehts/ jintropin hgh
https://linkifyer.com/adacharles3582 How Many Mg Of Hgh Per Day
https://www.3scomputers.com/demibergmann61 4iu hgh daily
https://xn--ciqaa.online/muoisteed4758 wehrle
https://www.workinternational-df.com/employer/hgh-kaufen-authorized-somatropin-bestellen/ Hgh vor dem Schlafen
https://epsontario.com/employer/wachstumshormone-hgh-kaufen-legal-in-deutschland-rezeptfrei/ Stallone Hgh
https://careers.primarycare24.org.uk/employer/epithalon-10-mg-epithalamine-peptide-kaufen-im-deutschland/ Hgh cycle
For Bodybuilding
https://qrscopy.com/kelleystingley how many iu hgh for bodybuilding
https://tyny.me/mollycourtney wehrle
https://imsgoavc.com/adanmonash8140 Hgh Dosage
iu bodybuilding
https://fanajobs.com/profile/abbiez05240030 hgh vs testosterone for muscle
https://mwcejobbank.webz.com.ng/employer/evogene-human-growth-hormone-one-hundred-iu-wachstumshormone waar staat hgh voor
https://vcarddesign.com/janieschulthei How Much Is
A Cycle Of Hgh
https://beta.we.pe/rUZjh Hgh Injections Side Effects
Цветы для свадьбы превзошли ожидания!
<a href=https://dostavkacvetovtomsk1.ru/>доставка цветов в томске</a>
Консультант подобрал букет по фото - точное попадание!
<a href=http://dostavkacvetovtomsk70.ru>доставка цветов в томске</a>
https://m.hrjh.org/charissa329646 craze Supplement banned
https://gitea.pnkx.top:8/etsukogresham most effective bodybuilding supplement
https://quickplay.pro/justinawrixon3 Legal Workout
Steroids
https://sistemagent.com:8081/jaynewebb58258 prescription steroid cream names
https://pschneider.fr/april33v255015 what are steroids
used for
https://intalnirisecrete.ro/@christelmarque steroids that cut
fat
https://www.ituac.com/berniecedowler anadrol and winstrol
http://9dnakedeye.com.cn:9001/annettbostick How steroids affect your
body
https://airplayradio.com/clarissafife64 do steroids help you lose weight
http://git.dashitech.com/darnellstone97 Wehrle
https://gitlab.rails365.net/hellenohman869 wehrle
https://rucollectshoeclub.com/read-blog/4552_dianabol-dbol-earlier-than-and-after-pictures.html gorilla
mass bulking Agent Review
http://git.qipqip.com/charla52x0983 Winstrol Gains
https://git.deadpoo.net/margaritadealb which of the following conditions is often associated with the abuse of
anabolic steroids?
https://finalresult.buzz/celindacountry nida gel
https://gitea.dokm.xyz/chester0824686 best muscle builder on the market
https://helx-artifacts-git.apps.renci.org/carmawillilams steroids classification
https://git.schoonbaert.net/cdnjovita23032 best stack
for weight loss and muscle gain
Заказала с открыткой "на вырост" - все оценили креатив!
<a href=https://chesskomi.borda.ru/?1-1-0-00002119-000-0-0-1752487670>доставка цветов в томске</a>
Букет из роз и протеи - экзотика и роскошь!
<a href=https://severussnape.borda.ru/?1-1-0-00000228-000-0-0-1754294976>купить букет роз томск</a>
Бант-бабочка придал упаковке трогательное очарование!
<a href=https://dostavkacvetovtomsk2.ru>купить розы в томске</a>
Роскошные пионы! Пышные и ароматные!
<a href=https://aktivnoe.forum24.ru/?1-9-0-00001217-000-0-0-1752048312 >гипсофилы цена букета</a>
Директор оценила мой вкус - спасибо за помощь!
<a href=http://dostavkacvetovtomsk70.ru>доставка цветов томск на дом</a>
Восхитительный сервис!Предложили несколько вариантов на выбор
<a href=https://buketytomsk70.ru/>цветы</a>
Срочная доставка спасла праздник - спасибо!
<a href=https://dostavkatsvetovtomsk.ru/>101 роза</a>
Великолепные каллы! Элегантные и стильные!
<a href=https://buketytomsk1.ru/>101 роза</a>
Заказала начальнице - оценила и вкус, и качество исполнения!
<a href=https://kupitrozyvtomske70.ru/>51 роза</a>
Идеальный выбор для мужчины! Строго и элегантно!
<a href=https://chesskomi.borda.ru/?1-8-0-00004409-000-0-0-1754995643>цветы томск</a>
Великолепный сервис! Упаковка бесплатно!
<a href=https://setter.borda.ru/?1-1-0-00001563-000-0-0-1754996074>свадебный букет</a>
Букет невесты - всё было идеально!
<a href=https://dostavkatsvetovtomsk.ru/>доставка цветов</a>
Букеты для воспитателей! Яркие и добрые!
<a href=https://buketytomsk1.ru/>купить пионы томск</a>
Великолепные композиции с фруктами! Сочные краски!
<a href=https://superogorod.ucoz.org/forum/2-3992-1>доставка цветов в томске</a>
Идеальный подарок коллеге!Поднял настроение всему отделу
<a href=https://buketytomsk70.ru/>доставка цветов томск</a>
Цветы пришли с милой открыткой - так трогательно!
<a href=https://dostavkatsvetovvtomske.ru/>заказать цветы томск</a>
Роскошные георгины! Крупные и яркие!
<a href=https://svstrazh.forum24.ru/?1-3-0-00000394-000-0-0-1754995191>купить цветы в томске</a>
Быстрая доставка с отслеживанием! Знаешь где заказ!
<a href=https://superogorod.ucoz.org/forum/2-3992-1>заказать цветы с доставкой в томске</a>
Розы с двухцветными лепестками - настоящий эксклюзив!
<a href=https://kupitrozyvtomske70.ru/>букет роз купить</a>
"Мужской" букет - брат был удивлен!
<a href=https://dostavkatsvetovtomsk.ru/>заказ цветов томск с доставкой</a>
Доставка в труднодоступные районы! Всегда найдут адрес!
<a href=https://buketytomsk1.ru/>букет цветов томск</a>
Отличный выбор горшечных растений!Все прижились прекрасно
<a href=https://buketytomsk70.ru/>гипсофилы цена букета</a>
Подобрали цвет букета под платье!
<a href=https://dostavkatsvetovtomsk.ru/>букеты томск</a>
Доставили в соседний город - цветы выглядели свежими, как местные!
<a href=https://kupitrozyvtomske70.ru/>букет роз цена</a>
Пушистые амариллисы! Величественные и роскошные!
<a href=https://buketytomsk1.ru/>заказ цветов томск с доставкой</a>
Великолепный сервис!Упаковали в подарочную бумагу бесплатно
<a href=https://buketytomsk70.ru/>доставка цветов томск</a>
Флористы поняли с полуслова!
<a href=https://dostavkatsvetovtomsk.ru/>заказ цветов томск</a>
Идеальный букет для учителя! Трогательный и элегантный!
<a href=https://chesskomi.borda.ru/?1-8-0-00004409-000-0-0-1754995643>свадебный букет</a>
Летние букеты! Яркие и сочные!
<a href=https://buketytomsk1.ru/>цветы</a>
Особенно понравилось, как аккуратно закреплены бутоны - ничего не рассыпалось!
<a href=https://kupitrozyvtomske70.ru/>купить розы</a>
Отличное качество зелени!Свежая и упругая
<a href=https://buketytomsk70.ru/>купить розы в томске</a>
Подарочные открытки! Трогательные слова к букету!
<a href=https://buketytomsk1.ru/>доставка цветов томск</a>
Восхитительные композиции с эвкалиптом!Свежо и стильно
<a href=https://buketytomsk70.ru/>розы томск</a>
Цветы создают настроение - получатель счастлив!
<a href=https://dostavkatsvetovtomsk.ru/>гипсофилы цена букета</a>
Ваши розы в упаковке с вощеной бумагой - винтажный шарм!
<a href=https://kupitrozyvtomske70.ru/>купить белые розы</a>
Букет пришел точно в указанный временной промежуток - ценим пунктуальность!
<a href=https://kupitrozyvtomske70.ru/>букет роз купить в томске</a>
Ваши флористы - гении своего дела!
<a href=http://dostavkacvetovtomsk70.ru>купить цветы томск</a>
Бодрящий цитрусовый аромат поднимал настроение с утра!
<a href=https://dostavkacvetovtomsk2.ru>купить цветы в томске</a>
Идеальный букет для бабушки! Теплый и душевный!
<a href=https://setter.borda.ru/?1-1-0-00001563-000-0-0-1754996074>французские розы</a>
Доставка в больницу - даже медсестры любовались!
<a href=https://dostavkatsvetovvtomske.ru/>купить цветы томск</a>
Прекрасные эустомы! Нежные и изящные!
<a href=https://pelsh.forum24.ru/?1-8-0-00000533-000-0-0-1754995967>101 роза</a>
Восхитительные полевые цветы! Нежный и душистый!
<a href=https://severussnape.borda.ru/?1-1-0-00000216-000-0-0-1752048830 >цветы</a>
Великолепный сервис! Упаковка бесплатно!
<a href=https://chesskomi.borda.ru/?1-8-0-00004409-000-0-0-1754995643>букет невесты</a>
"Что-то весёлое" - получила салют из гербер!
<a href=https://dostavkatsvetovvtomske.ru/>доставка цветов</a>
Ваши цветы - это "я тебя люблю" без слов!
<a href=https://dostavkatsvetovvtomske.ru/>букет невесты томск</a>
Розы как шёлковые - ни одного повреждённого лепестка!
<a href=https://dostavkatsvetovvtomske.ru/>купить пионы томск</a>
Цветы для свадьбы превзошли все ожидания! Все гости были в восторге!
<a href=http://dostavkacvetovtomsk70.ru>букет цветов томск</a>
Мини-розы в горшочке - мило и практично, продолжают радовать!
<a href=https://chesskomi.borda.ru/?1-1-0-00002118-000-0-0-1752486782>розы томскрозы в Томске</a>
Заказываю не первый раз - всегда безупречное качество и пунктуальность!
<a href=https://dostavkatsvetovvtomske.ru/>заказать цветы с доставкой в томске</a>
Прекрасные настурции! Яркие и необычные!
<a href=https://automobilist.forum24.ru/?1-5-0-00001581-000-0-0-1752049408 >букеты томск</a>
https://jobstaffs.com/employer/ipamorelin/ can you take ipamorelin and semaglutide together
https://scfr-ksa.com/employer/cjc-1295-ipamorelin-dosage-calculator/ side
effects of ipamorelin and cjc
http://my-urls.de/carolmilligan7 ipamorelin how much to
take
https://lavorare.eu/companies/ipamorelin-peptide-dosage-benefits-side-effects/ ipamorelin high blood pressure
https://getshort.in/imashivers5629 Ipamorelin studies
https://internship.af/employer/cjc-1295-ipamorelin-the-benefits-of-peptide-therapy/ ipamorelin and cjc 1295 dosage
http://www.carnevalecommunity.it/author/hannelorefi/ ipamorelin 2mg axiom peptides benefits
https://allanstaffingagency.com/employer/cjc-1295-vs-ipamorelin-which-peptide-delivers-the-best-muscle-gains/ Ipamorelin 5Mg Factory
https://www.vytega.com/employer/ipamorelin-vs-sermorelin-which-peptide-therapy-is-right/ ipamorelin and sermorelin injection
https://coopervigrj.com.br/employer/what-is-cjc-1295-ipamorelin/ Cjc-1295 Ipamorelin 10Mg Blend Should Lasyt
https://tictaccollection.life/moiseszaleski tesamorelin ipamorelin blend dosage
http://easyoverseasnp.com/employer/ipamorelin-peptide-everything-you-should-know/ cjc 1295 ipamorelin no dac dosage
https://contact-us.my/jackie04x40914 which
is better ipamorelin or sermorelin
https://t-iny.com/lucaskelly192 cjc-1295 ipamorelin monthly cost
https://pridestaffing.us/companies/ipamorelin/ valley
https://ncardnepal.com/kelleybarnhill ipamorelin acetate supplier linkpeptide
https://www.awaker.info/home.php?mod=space&uid=7440571&do=profile&from=space ipamorelin igf 1
suppliers
https://301.tv/cassandrapococ ipamorelin peptide pricelist
https://hedgedoc.digillab.uni-augsburg.de/981G2DUYSQiEX6HfRqOywA/ benefits of tesamorelin ipamorelin
https://setiathome.berkeley.edu/show_user.php?userid=13192262 ipamorelin nasal spray dosage
https://topspots.cloud/item/459497 cjc 1295 ipamorelin price
https://noticias-sociales.site/item/462146 ipamorelin cjc 1295 dosage reddit
https://peatix.com/user/27703115 cjc-1295/Ipamorelin protocol
https://intensedebate.com/people/headburn23 cjc 1295
ipamorelin itchy skin
https://xypid.win/story.php?title=comparing-tesamorelin-and-ipamorelin-understanding-the-differences cjc-1295/ipamorelin vs
Mk 677 reddit
https://molchanovonews.ru/user/epoxygreek8/ cjc 1295 ipamorelin nasal spray
dosage
https://wtools.biz/user/kenyalisa80/ valley
https://doc.adminforge.de/Igip_9bqRlWFncNqQ3eqHw/ cjc 1295 Ipamorelin safety
http://pattern-wiki.win/index.php?title=bynumblanton2030 cjc ipamorelin half life
https://doc.adminforge.de/Igip_9bqRlWFncNqQ3eqHw/ ipamorelin peptide oral
https://muhammad-ali.com.az/user/pointchick5/ ipamorelin dose 100
https://pad.fs.lmu.de/MNNsg3cmRcKkm20p7_Q2fg/ cjc 1295 ipamorelin before and after
https://noticias-sociales.space/item/461696 mod grf 1-29 ipamorelin 100mcg
https://doc.aquilenet.fr/DeWreNPoRtK9vjP9d3TeVg/ cjc 1295 + ipamorelin results reddit
https://telegra.ph/6-Months-On-CJC-1295-Ipamorelin-Here-Is-What-Happened-09-02 ipamorelin 5mg
https://topspots.cloud/item/459476 cjc-1295 ipamorelin blend orlando
https://git.gymnasticstuff.uk/mohammadmessie valley
https://git.mista.ru/bart70x9813837 ipamorelin muscle growth benefits
https://heywhatsgoodnow.com/@salvatoreparad heywhatsgoodnow.com
http://tigerpi.cn:3000/lakeshadju7658 Tigerpi.Cn
https://beatsong.app/alfonzoasmus67 valley
https://git.van-peeren.de/geniebatey0679 cjc1295 & ipamorelin
https://gitea.rodaw.net/birgitv7236048 Is Cjc 1295 Ipamorelin Fda Approved
https://clone-deepsound.paineldemonstrativo.com.br/georgettahawks valley
https://gitea.ontoast.uk/peter35a263659 injecting ipamorelin
https://git.lodis.se/tobiasbair7310 Ipamorelin How Long To Take
https://gogs.soyootech.com/feliciaeisen0 https://Gogs.soyootech.com/
https://lovematch.com.tr/@shantellchave https://lovematch.com.tr/@shantellchave
https://app.fitlove.app/@isiahborders61 Valley
https://git.sayndone.ru/elizbethbyrnes ipamorelin acetate cost
http://www.mmgold.top:8103/regenadeathera http://www.mmgold.top:8103/regenadeathera
https://gitea.blubeacon.com/kassieoconner cjc 1295 ipamorelin cost per month
https://mozride.com/@rosspeeples54 where can i get cjc 1295 ipamorelin
https://jamdiggy.com/zofarianne2726 valley
https://cannabisjobs.solutions/companies/6-months-on-cjc-1295-ipamorelin-here-is-what-happened/ ipamorelin 15mg /
cjc 1295 6mg
https://f-ast.me/dian9598795971 cjc-1295 ipamorelin buy
https://myshorturls.com/fkdstar970081 Valley
https://dialsexe.pro/mickiedelee32 ipamorelin with sermorelin and
cjc 1295
https://cvbankye.com/employer/cjc-ipamorelin-uncovered-key-benefits-and-faqs/ Cjc 1295 ipamorelin Fertility
https://jobs.askpyramid.com/companies/cjc1295-ipamorelin-ghrp-2-dosage/ valley
https://afghanistan24.com/employer/ipamorelin-cjc-1295-dosage-synergistic-effects-for-growth-hormone-release/ ipamorelin legal status 2025
https://dokdo.in/rileysmothers does Cjc-1295 ipamorelin increase testosterone
https://careerfy.pl/employer/the-heart-of-the-internet/ cjc 1295 Ipamorelin how Long to see
Results
https://sublimejobs.co.za/employer/mk-677-pros-and-cons-weighing-the-benefits-against-the-risks/ does cjc 1295 ipamorelin cause weight
gain
https://prabeshgroup.pl/employer/peptide-nasal-sprays-a-new-path-to-health-and-wellness/ fragment 176-191 & cjc-1295 & Ipamorelin for sale
https://jobs.foodtechconnect.com/companies/ipamorelin-benefits-uses-and-side-effects/ cjc
1295 ipamorelin ghrp 2 blend dosage
https://cipher.lol/cedricrauch16 Ipamorelin Nasal Spray Effectiveness
https://kisalt.co/egnkeri4542453 can you drink alcohol while taking
ipamorelin
https://www.fightdynasty.com/companies/cjc-1295-ipamorelin-10mg-blend-dosage/ oral efficacy of sermorelin ipamorelin cjc 1295
https://jobrails.co.uk/employer/understanding-ipamorelin-and-its-role-in-anti-aging-and-hormone-therapy/ ipamorelin pros
and cons
https://inftag.com/feamilan6 buy fragment 176-191 & mod grf 1-29 & ipamorelin blend
https://aparca.app/bennett526979 cjc-1295
ipamorelin benefits uses
https://www.jobzalerts.com/companies/how-much-cjc-1295-ipamorelin-should-i-take-explained-by-tulsi/ where Can i Get ipamorelin
https://www.amworking.com/employer/cjc1295-ipamorelin-ghrp-2-dosage/ valley
https://www.famahhealthcareservices.com/employer/ipamorelin-vs-sermorelin-decoding-the-differences-in-peptide-therapies/ Cjc 1295/Ipamorelin How Long To See Results
https://bkksmknegeri1grati.com/employer/cjc1295-ipamorelin-dosage-crafting-the-perfect-regimen/ sermorelin &
ipamorelin blend
https://jobsbotswana.info/companies/tesamorelin-and-ipamorelincombined-growth-hormone-therapy/ ipamorelin allergic reaction
http://www.grainfather.co.uk/employer/the-anti-aging-benefits-of-cjc-1295-and-ipamorelin How often do you take ipamorelin
https://urlyshort.pro/graigboismenu7 valley
http://hornjobs.org/employer/the-heart-of-the-internet how Long
before meal ipamorelin
https://quierotrabajo.com.py/companies/ipamorelin-dosage-calculator-and-chart-a-z-guide/ purchase
ipamorelin
https://saek-kerkiras.edu.gr/employer/ipamorelin-what-it-is-how-it-works-and-why-its-popular/ ipamorelin dosage
for anti aging
https://lamachineataffer.com/entreprises/a-closer-look-at-the-combination-of-cjc-1295-and-ipamorelin/ ipamorelin and sermorelin injection locations
https://midomesticard.com/employer/cjc-1295-ipamorelin/ mod grf 1-29 & Ipamorelin blend
for Sale
https://wisewayrecruitment.com/employer/hexarelin-vs-ipamorelin-the-definitive-peptide-guide/ cjc-1295/ipamorelin injection site
https://linksshortcut.com/wilhelminahopl how
long can you stay on cjc-1295 ipamorelin
https://jobfair.bu.ac.th/employer/ipa-cjc-guide/ sermorelin & ipamorelin
https://xshort.site/nidiakidman738 ipamorelin cjc 1295 Oral tablets
https://www.opad.biz/employer/ipamorelin-vs-sermorelin-heres-what-you-need-to-know/ cjc 1295 with
ipamorelin dosage
https://blandonew.com/employer/ipamorelin-peptide-everything-you-should-know/ cjc 1295 5mg ipamorelin 9mg
https://telegra.ph/Tesamorelin--Ipamorelin-Peptide-Therapy-Benefits-Protocols--Result-09-02 cjc 1295 ipamorelin women
https://telegra.ph/6-Months-On-CJC-1295-Ipamorelin-Here-Is-What-Happened-09-02 ipamorelin negative side effects
https://skitterphoto.com/photographers/1376862/hovgaard-barnes Ipamorelin Dosage Calculator
http://www.stes.tyc.edu.tw/xoops/modules/profile/userinfo.php?uid=3688145 valley
https://telegra.ph/Ipamorelin-Dosage-For-Fat-Loss-Benefits-And-Side-Effects-09-02 can zma be taken with ipamorelin
https://www.fionapremium.com/author/nestburst71/ does cjc-1295 ipamorelin increase testosterone
https://www.udrpsearch.com/user/plowgrey6 tesamorelin + Cjc1295
+ ipamorelin 12Mg blend dosage
https://graph.org/6-Months-On-CJC-1295-Ipamorelin-Here-Is-What-Happened-09-02-2 tesamorelin + cjc1295 + ipamorelin 12mg
https://enoticias.site/item/338704 ipamorelin 2mg mixing
https://telegra.ph/CJC-1295-With-DAC-Dosage-A-Detailed-Guide-09-02 when should you take ipamorelin
https://telegra.ph/Ipamorelin-Dosage-For-Fat-Loss-Benefits-And-Side-Effects-09-02 ipamorelin sermorelin bodybnuilding
https://gratisafhalen.be/author/golfriddle02/ ipamorelin 2mg Axiom peptides for sale
http://www.stes.tyc.edu.tw/xoops/modules/profile/userinfo.php?uid=3688088 ipamorelin/cjc vs sermorelin
https://telegra.ph/6-Months-On-CJC-1295-Ipamorelin-Here-Is-What-Happened-09-02 sermorelin With ipamorelin
https://gratisafhalen.be/author/iranstew5/ ipamorelin more plates more
dates
https://satoil.kz/author/floodtub85/ valley
https://www.fionapremium.com/author/radarsalmon0/ ipamorelin dosage guidelines
https://www.udrpsearch.com/user/fridgeweapon8 when is the best time to take ipamorelin
https://tubemone.com/@dirkbartley993?page=about are There Any legal steroids
https://mystdate.com/@albertoormisto Steroid With Least Side Effects
http://zahbox.com/@concettacassid?page=about valley
https://git-i.ir/brandieveilleu best muscle Building Stacks
https://hafrikplay.com/augustuspalma bodybuilding steroids for beginners
https://geniusactionblueprint.com/@irwincarranza4?page=about anabolic_steroid
https://abadeez.com/@berndzuniga461?page=about hormone classification chart
https://zm.aosenhw.com/@ethelbickford steroidsonline.co review
https://nijavibes.com/irawatson8335 substance from which steroid hormones are made
http://git.veilytech.com/u/darellbeaurega where to
buy legit dianabol
https://lonestartube.com/@cassandrahindw?page=about sus and deca before and after
http://git.edazone.cn/glennsaucedo9 best Steroid For
athletic performance
https://csmsound.exagopartners.com/janeengreaves valley
https://www.tmip.com.tr/@arleneson34414?page=about valley
https://heyyo.social/@erik83x1382374?page=about trenbolone cutting
cycle
https://theindietube.com/@annettemauro91?page=about drugs gear
https://gitea.gm56.ru/ersavis7558178 Steroid Guides
https://git2.huai-yun.com/abbyserle8477 bulking steroid.cycles
https://apnatube.in/@lorichaney252?page=about best anabolic stack
https://familyworld.io/@barteisenhauer?page=about non aromatizing
steroids
https://catsdev.com/budscherk1058 steroids women
https://git.saidomar.fr/gregorio71s708 valley
https://git.tordarus.net/errol981208017 Anavar Steroids
https://rictube.com/@gretchencasper?page=about Purchase Steroids
https://wtube.net/@derrickczn2502?page=about how
much does dianabol cost
https://myhealthypunjab.com/@ernamcneal5177?page=about research chemicals bodybuilding
https://thescouter.co.uk/@braydenlorimer?page=about bulk cycle stack
https://theindietube.com/@annettemauro91?page=about 4
week Steroid cycle
https://quickdatescript.com/@athenamccray53 what is
the definition of anabolic steroids
https://slowdating.ca/@donettekort255 Substance From Which steroid
hormones are made
https://www.oddmate.com/@joesphsimone09 valley
https://git.bigtravelchat.com/darrensyy09310 bodybuilding using steroids
http://git.baobaot.com/angelinar93493 tren anadrol
https://gitea.mocup.org/darnellmurphy7 Healthy Steroids
https://healedonly.com/@halinagallegos anabol cycle
https://mzansinyash.com/@danielereilly6?page=about mental health cases in steroid abuse|acybgntbgv0jfnkoyks0e75iu3dejdmsdw:***
<a href=https://aktivnoe.forum24.ru/?1-7-0-00017138-000-0-0-1756885856>пионовидные розы Томск</a>
https://www.adultgg.com/@augustusdrenna?page=about connor murphy steroids
https://git.dsvision.net/danutasharpe3 buying illegal steroids online
https://hanyunmedical.com/arronmadden249 natural steroids in the body
https://git.mopsovi.cloud/candicekemble buy oral winstrol
https://git.snowcloak-sync.com/daleweindorfer Valley
https://vigilanteapp.com/@johngiles32394?page=about purchasing steroids online
https://revenu.live/@cyrusandrzejew?page=about valley
https://git.barant.com/ginolegrand72 Mass
Gaining steroids
https://bhojiwoods.com/@rfvahmad551174?page=about valley
https://cupido.prestigioapps.com/@bradleya072482 crazy muscle gains
https://udayah.com/@katiaclever846?page=about Ra anabolic Stack
https://dreamplacesai.de/ezrajephcott73 where to buy legit dianabol
https://git.rec4box.com/colette6898418 legal testosterone for
sale
https://luvwing.com/@lizguy89951099 when did steroids become popular
https://easyconnect.fun/@kicjanet293934 valley
https://git.galaxylabs.ca/sebastiankinse valley
https://www.suyun.store/danielearls544 Valley
http://dev-gitlab.dev.sww.com.cn/monteclutter15 what effects do steroids
have on the body
https://rymmusic.com/francesco0213 valley
https://ionvideo.org/@jakemerritt94?page=about Do steroids make you
Stronger
https://www.jccer.com:2223/isabelcurrey92 what happens if i side with
the institute
http://www.huastech.com.cn:81/chantalurban60 weight gain steroid
https://git.van-peeren.de/cpxkathryn087 best Testosterone injections for Bodybuilding
https://git.zeroplay.io/alison98485407 what is in steroids
http://git.jishutao.com/byronlemmons9 what
are the risks of using anabolic steroids
https://git.wun.im/cornellseptimu beast super test gnc
https://vibecodetogether.com/milfordflorez4 where to buy
steroid online
https://dhivideo.com/@finnzimmer6093?page=about anabolic
pathways definition
https://www.chenisgod.com:3096/allie24j977071 valley
https://rhapsodyofrealities.abilliontestimoniesandmore.org/@kieranoconnor5?page=about Anadrole
amazon
http://www.mindepoch.com:9092/deldozier5315 valley
https://newsflip.in/@hildredestrada?page=about valley
https://watchnpray.life/@aldapflaum8726?page=about bodybuilding com steroid
https://saga.iao.ru:3043/earnestinepent closest
thing to steroids but legal
https://www.appleradish.org/consuelocadman how do Bodybuilders get
steroids
https://csmsound.exagopartners.com/janeengreaves valley
https://datingmywish.com/@jodiecoury3480 natural muscle builders
https://git.tbaer.de/guadalupeaylwa is it legal to buy steroids online
in the uk
https://blackbirdstory.com/@finleytenison?page=about illegal
anabolic steroids before and after
https://git.xemo-net.de/jenslent400419 where to buy legit steroids
https://hunthub.com.au/@carissasoul489?page=about winstrol steroids for sale
https://git.lmskaran.com/derekheady8261 alternative To Steroids
https://www.arabianmatrimony.com/@norma42i742370 Valley
https://auntybmatchmaking.com/@louiepqf810213 once growth Stunting occurs
https://videos.awaregift.com/@kayleedoyle40?page=about Best
Non steroid muscle builder
https://bash.tube/@felicitassearl?page=about valley
https://qarisound.com/derrickmarko86 best steroid
pharmacy
https://supardating.com/@caitlynsani171 best steroids for muscle growth
https://code.luoxudong.com/josefinalipsco why do anabolic steroids differ from other illegal drugs?
https://ethericquestions.com/@manualshippee2?page=about what can steroids do to
your body
https://youmiru.com/@davishauser763?page=about valley
https://gitea.pnkx.top:8/angelinamcshar How to get dianabol
https://music.shaap.tg/mammiek5192100 Synthetic Steroids
Gnc
https://camtalking.com/@brady70c384624 steroids long term effects
Я в полном восторге от сервиса! От заказа до получения прошло меньше часа. Букет был идеально упакован и доставлен к важному для нас моменту. Вы лучшие!
<a href=https://severussnape.borda.ru/?1-1-0-00000228-000-0-0-1754294976>51 роза томск купить</a>
https://www.meetgr.com/@annawvo102266 best steroids uk
http://jatushome.myqnapcloud.com:8090/felicachuter19 what causes
jealousy in the brain
https://www.pulaplay.com/@samanthahuber?page=about valley
https://git.saintdoggie.org/domenicschweit steroids should they be legalized
https://git.galaxylabs.ca/stellaklinger7 Valley
https://seelgol.com/@laraestookey31?page=about Valley
http://shqkxh.org:3000/nellie27l27156 valley
https://musiccosign.com/jeremyradcliff Real
Anabolic Steroids
https://www.broutube.com/@chaupowlett795?page=about how to properly use steroids
https://git.werkraum-karlsruhe.org/antoniahartin1 purchase steroid
https://bfreetv.com/@cindy69056283?page=about safest Steroid
to Take
https://gitlab.oc3.ru/u/mariamsoubeira ripped muscle extreme gnc
http://shqkxh.org:3000/wilbursharman6 is larry wheels on steroids
https://playxtream.com/@carlotahanger1?page=about massive testo price
https://ltube.us/@archerfreame43?page=about best stacks for muscle growth
https://playbaux.com/@jimcavill55977?page=about negative side
effects of sam-e
http://spnewstv.com/@kerridacomb01?page=about dianobol effects
https://truthtube.video/@shellakuefer0?page=about is clear muscle a steroid
https://silatdating.com/@harveyegan709 bodybuilding store near me
https://www.ituac.com/coreybannerman steroid cycle for sale
https://naijasingles.net/@celsapelletier steroid buy online
https://sistemagent.com:8081/isidra94f30909 oral steroids online
https://git.itbcode.com/benedictrasco0 closest supplement
to steroids 2016
https://git.lmskaran.com/leilabodiford online steroids
https://ophiuchus.wiki/kristie4638425 Supplements with steroids
https://gitea.questline.coop/consuelowicker valley
https://git.ultra.pub/caitlyn3813206 steroids names for
bodybuilding
https://9jadates.com/@calliestarns7 does rich piana take steroids
https://lius.familyds.org:3000/craigbarone74 Gnc
Muscle growth Supplements
https://kingpeter.ewsstagging.com/arielbenjafiel buy
online steriods
https://www.nemusic.rocks/brigida99c5514 side effects of the use of anabolic steroids include
which of the following conditions?
https://music.1mm.hk/autumnhester7 anabolic steroids Injectable for sale
https://git.entryrise.com/basillemos5572 prices of steroids
https://git.pcgf.io/dan51h74755138 is buying steroids online illegal
https://voicync.com/doragopinko91 best steroid stack for cutting
https://gitea.belanjaparts.com/rosemarylundgr Valley
https://gitlab.catamarca.gob.ar/u/majorjolly4070 Mass Building Steroids
https://englishlearning.ketnooi.com/@trevorbutterfi?page=about steroid side effects in men
http://share.pkbigdata.com/keiraborowski8 natural bodybuilding
vs steroids
https://computerhalle.eu/nelliewebb1862 valley
https://git.burokratgroup.ru/chetharms6803 beast super test
side effects
https://udayah.com/@katiaclever846?page=about purchase
anabolic steroids
https://stream.sevenmhf.com/@dellatackett43?page=about steroid before and after
https://btslinkita.com/@rodrigohodgett?page=about how do anabolic steroids cause liver damage
https://sithcom.de/brittnyharwell gnc muscle growth supplements
https://unitedmusicstreaming.com/vfnorval52143 valley
https://music.1mm.hk/coletteburnsid Use Of Steroids
https://dating.hyesearch.com/@reagan26b51609 can prednisone
cause missed periods
https://git.atomos.io/numbershumble supplement closest
to steroids
https://media.motorsync.co.uk/@reginastace27?page=about valley
https://gitea.coderpath.com/williamswestmo valley
https://gitea.mpc-web.jp/kareemoxley940 steroid starter pack
https://git2.huai-yun.com/shelleywestmac primo steroid
https://git.nightime.org/melodeefrantz1 steroids build muscle
https://devops.rs2i.fr/nolanmorrison8 define steroids
https://rymmusic.com/amoshowland125 valley
https://github.bigdatatech.vn/chaunceysevers How Long Does Winstrol Take To Work
https://afrotapes.com/christiedarby3 best legal testosterone
steroid
http://provision-sa.co.za:3000/alfonzonoskows safest injectable steroid
https://intimsync.com/mdzcarmella677 legit steroids source
https://gitea.quiztimes.nl/ethanlions2610 best place to buy steroids 2015
https://music.drepic.com/enriquetabirmi rapid tone diet pills reviews
http://gitlab.dev.jtyjy.com/delorasosborne steroid
injections for muscle building
https://code.miraclezhb.com/angelitafoos93 anabolic steroids canada
https://matchmadeinasia.com/@hudsonmccrary Symtoms Of
Steroid Use
https://git.furcom.org/antoinettemait deca and winstrol
http://git.linkupx.com/charolettekula any legal steroids
https://git.atomos.io/flynnx60320535 do strongmen use
steroids
https://heartbeatdigital.cn/dora77g6232867 Valley
https://gitea.services.gsd-srv.com/chandrad575615 Valley
https://gitea.cncfstack.com/jerestallworth Top 10 steroid
https://easyconnect.fun/@alexandriapack Rich piana steroid Cycle Instagram
Ни одного увядшего лепестка! Все розы были идеальны. Видно, что за продукцией следят и доставляют её в лучшем виде.
<a href=https://chesskomi.borda.ru/?1-1-0-00002164-000-0-0-1754295301>пионовидные розы Томск</a>
Роскошные дельфиниумы!Высокие и статные!
<a href=https://cah.forum24.ru/?1-13-0-00002603-000-0-0-1756470315>доставка цветов в томске</a>
https://www.ptpraxis.gr/en/qa_pregnancy-childbirth-and-postpartum-care-in-the-services-of-p-t-praxis/ fast muscle
growth steroids
https://smait-ulilalbabbatam.sch.id/353-2/ were to buy
anabolic steroids
https://enoplois.gr/2023/03/04/%ce%bf-%cf%81%ce%bf%cf%86%cf%8c%cf%82-%cf%80%ce%bf%cf%85-%ce%ad%ce%ba%ce%bf%cf%88%ce%b5-%ce%ba%ce%b1%ce%b9-%ce%ad%ce%bd%ce%b1-%cf%8c%ce%bc%ce%bf%cf%81%cf%86%ce%bf-%cf%86%ce%b1%ce%b3%ce%ba%cf%81/ what is
anabolic
https://galaxyslotsonline.uk/strategies-for-winning-big-amazing-link-bounty-slots/ which of
the following effects of anabolic steroids on women is not reversible?
http://icbh.co.za.www117.jnb2.host-h.net/BLOG/NES/FAQ-S/index.php/;focus=HETZA_com_cm4all_wdn_Flatpress_1022440&path=?x=entry:entry170828-024838%3Bcomments:1 valley
https://elearnportal.science/wiki/Anavar_Oxandrolone_The_Ultimate_Guide what are steroids and why are they dangerous
https://wood-swordcricket.com/product/armour-ik2-wicket-keeping-inners-white-blue/ steroid long term side effects
https://embedthreads.com/question/msp430-texas-controller-dsp-library/ taking
anabolic Steroids to look more muscular is an Example of:
https://hedgedoc.digillab.uni-augsburg.de/m7nm6BTzTsuexjaAGApU3g anabolic steroids
effects
https://houseforart.com/product/blue-white-the-rocks-in-belle-ile-framed-wall-art/ best
legal supplement to get ripped
https://vanosengineering.nl/rd_01/ how do steroids enter the body
https://projetocimm.com/fausto/ valley
https://rsud.dompukab.go.id/laporan-indikator-indikator-mutu-nasional.html Clenbuterol Side Effects Hair Loss
https://beautyease.org/mandie-kaii-net-worth/ gnc
Alternative
http://restgarage.jp/blog.php?aidx=136380 what are steroids
used for in the body
https://tourpassion.com/tour-passion-in-reykjavik-double-decker-coaches-for-seamless-large-group-transfers/ valley
https://le-k-reims.com/events/enrico-macias/ deka steroid
https://informatusa.com/traspaso-de-restaurantes/ buying steroids online reviews
https://axecapitalworld.com/2023/05/04/hello-world-5/ Steroid To Build Muscle
Fast
https://www.r2iclubforums.com/viewtopic.php?f=68&t=222585&view=print best stack
to gain muscle and lose fat
https://fotohana.fi/5-yleisinta-virhetta-trukin-kaytossa-ja-miten-valttaa-ne/ what
type of drugs are steroids
http://www.pallas.co.jp/blog.php?aidx=223076 where can i buy anabolic steroids
https://zhuhong.ru/%d0%be%d0%b3%d0%bd%d0%b5%d1%83%d0%bf%d0%be%d1%80%d0%bd%d0%b0%d1%8f-%d0%bc%d0%be%d1%80%d1%81%d0%ba%d0%b0%d1%8f-%d1%82%d1%80%d1%83%d0%b1%d0%bd%d0%b0%d1%8f-%d0%bc%d1%83%d1%84%d1%82%d0%b0/ anabolic steroids short term
effects
https://debbycreative.com/stylish-grooms-guide-what-to-wear-on-your-big-day/ what do steroids
do to women's bodies
http://www.ynkikou.co.jp/hpgen/KEIJ/light.cgi?res=53521 How do peds work
https://ekkamhardware.com/product/classic-service-bar-rail-oil-rubbed-bronze-2-od/ valley
http://restgarage.jp/blog.php?aidx=143571 no max shred side effects
https://club.virolight.ru/osveshchenie-v-detskoy-komnate/ albuterol dose for weight loss
https://setiathome.berkeley.edu/show_user.php?userid=13092393 Anadrol legal
https://dramanews168.com/archives/2198 best illegal steroids
http://190.205.35.131/?p=9198 do steroids make your dick smaller
https://ecommerce.markathinkdigital.com/product/zesco-ripe-bananas/ valley
https://le-k-reims.com/events/revue-femmes-mythik-10/ legal
steroids stacks
https://theracorretora.com/the-art-of-pitching-how-to-win-over-investors/ top legal steroids 2018
https://joanrey.com/fall-in-love-with-new-poetry/ is dianabol legal?
https://papocultura.com.br/portugal-e-natal/ best supplements to get jacked
http://smf.prod.legacy.busites.com/index.php?topic=596065.0 steroid store online
https://kaospolosaneka.com/fakta-fakta-unik-fashion-yang-penting-buat-kamu-ketahui/ best steroid for
lean muscle mass
https://taxipuntacanabelen.com/product/one-day-deep-sea-fishing-barbados/ legal steroids weight
Loss
https://papocultura.com.br/mercado-de-petropolis/ performance enhancing drugs facts
https://fncp.org.br/2024/02/14/1xbet-%d0%be%d1%84%d0%b8%d1%86%d0%b8%d0%b0%d0%bb%d1%8c%d0%bd%d1%8b%d0%b9-%d1%81%d0%b0%d0%b9%d1%82-%d0%ba%d0%b0%d0%b7%d0%b8%d0%bd%d0%be-%d0%b8%d0%b3%d1%80%d0%be%d0%b2%d1%8b%d0%bc%d0%b8-%d0%b0%d0%b2/ extreme muscle enhancement
https://getpro.gg/services/mountaintop/ Best Steroid for weight loss
https://barugo.click/2024/11/20/hello-world/comment-page-255/ Valley
https://seabreezehomesandliving.com/coastal-chic-10-must-have-coastal-decor-ideas-part-1/ valley
http://inori.s57.xrea.com/ss/photo.cgi?mode=res&resno=89336 steroids effect on the
body
https://www.jewishlegalnews.com/karen-fiss-v-california-college-of-the-arts/ how bad are steroids
for you
https://unitedgamingsports.uk/historical-context-of-romania-liga-1-fc/ valley
https://www.digitel-srl.it/logo-web-digitelsrl/ legal supplements that act like steroids
https://fashionv.org/peso-pluma-height-and-weight/ how to take deca
https://decoratingmycoziness.com/plants-for-the-garden-the-hibiscus/ oral steroids bodybuilding
https://newsstroy.kharkiv.ua/v-finlyandii-zapustili-v-rabotu-samuyu-bolshuyu-peschanuyu-batareyu-v-mire.html steroids like
supplements
https://gsa9game.net/demon168/ why are anabolic steroids illegal
https://qaq.com.au/2015/06/12/japanese-inspired-decorating-with-the-tokyo-decorative-screen-design/ hgh
steroid cycle
https://mililie.com/ruribitakiao/ valley
Спасибо за идеи с персонализированными открытками! Заказала розы на 8 Марта с персональным поздравлением - мама сохранила открытку!
<a href=https://t.me/cvetaevatomskru/598>заказ цветов томск с доставкой</a>
Отличный сервис!Индивидуальный подход!
<a href=https://setter.borda.ru/?1-1-0-00001601-000-0-0-1756469773>цветы томск</a>
Спасибо за лёгкость в общении! На все мои вопросы ответили быстро и подробно. Чувствуется, что вы действительно хотите помочь клиенту.
<a href=https://chesskomi.borda.ru/?1-8-0-00004528-000-0-0-1756886174>купить розы в томске</a>
https://gitea.theaken.com/brendabromby4 Most used steroid
http://nas.bi1kbu.com:8418/mavisrex714231 Valley
https://pilowtalks.com/@anjaherrmann97 how to tell if someone uses steroids
https://git.nuansa.co.id/corinabackhous Best muscle builder on the market
https://git.koppa.pro/bryceroach1245 Powerlifting steroid Cycles
https://git.stit.tech/barney57r12560 best Muscle cutting supplement
https://adufoshi.com/rodrigoandrus natural muscle Vs steroids
https://git.intelgice.com/annettedarvall Azinol anabolic Agent
https://gitea.alaindee.net/hyebaptiste402 anabolic steroids and prostate cancer
https://9jadates.com/@calliestarns7 cutting results bodybuilding
https://git.migoooo.com/coralglaspie0 mike o'hearn steroids
https://git.nuansa.co.id/corinabackhous When did steroids become illegal
http://gitea.liaozhuangkeji.com/kaceybaracchi legal Steroids uk
buy
https://git.auwiesen2.de/carissajiron48 diet pill that blocks fat absorption
https://gitea.ideaopen.cn/darellvanburen What are the best steroids to take
https://backingmixes.com/brentmanzi4635 are steroids
legal in england
https://gogs.kakaranet.com/luisabecerra4 valley
https://gitea.adminakademia.pl/hassie48836295 natural steroid supplement
https://zm.aosenhw.com/@caryncuster209 best steroid for muscle recovery
https://gitea.synapsetec.cn/latasha8906366 How to use anabolic steroids safely
https://silatdating.com/@harveyegan709 legal anabolic supplement
https://www.cupidhive.com/@leticiacolston is testosterone powder illegal
https://music.shaap.tg/brendandunaway deca injection bodybuilding
https://selfloveaffirmations.net/@beatrisirving6 reddit steriods
https://git.j.co.ua/efrenbleasdale what does steroids do to your body
https://git.vce.de/karolynpotts20 order anabolic steroids online
https://gitea.cncfstack.com/jerestallworth valley
https://music.vp3.me/williemacias74 steroids|alekk00d2yr5zwgei_j3cauqupgquqhozg:
***
https://git.mista.ru/daisychildress best steroids
for weight loss
https://music.growverse.net/biancahuddlest list of anabolic steroids
https://cupido.prestigioapps.com/@chasitymills0 valley
https://code.luoxudong.com/ambrosecdg2522 steroids symptoms
https://devops.rs2i.fr/nolanmorrison8 where to get steroids
in the us
https://qimley.com/@alexandrapxs1 how do steroids affect the body
https://meeting2up.it/@calebloe857866 steroid forums sources
https://mp3diary.com/lois02f7879156 Does Anavar Cause Hair
Loss
https://www.aservicehost.ru/collinshanahan what countries are
steroids legal
https://git.nuansa.co.id/corinabackhous peak life testosterone side effects
https://www.kornerspot.com/@jerilynhuot374 androgenic drugs
https://git.siin.space/catherinestump best steroids For
crossfit
https://syq.im:2025/bonita87d3524 make trenbolone
https://gitea.joodit.com/emiliabanuelos negative effects of steroids
http://iskame.bg.cm/@mariocann06540 Legit Steroid Website
https://git.agusandelnorte.gov.ph/audreadelfabbr Steroids muscle
Mass
https://code.openmobius.com:3001/cathleenhairst valley
https://kition.mhl.tuc.gr/antoniomartino valley
https://git.outsidecontext.solutions/athenahennessy are any steroids legal
https://www.besolife.com/@jonpridham514 negative affects of steroids
https://rearch.engineer/cathydurkin831 steroid trenbolone
https://www.fuzongyao.cn/ezequielhirsch what is anabolic
https://loveis.app/@andreascarberr scientific name
for steroids
https://ljs.fun:19000/dalenewright9 where can I get legal steroids
https://git.alexavr.ru/christinbladen best muscle building supplements at gnc
https://git.the-kn.com/gonzalobourass Natural Anabolic Supplements
https://finalresult.buzz/andrenoack210 best non steroid supplement for muscle growth
https://code.dsconce.space/alvasimcox9953 valley
https://musiccosign.com/johnmaccormick best steroid for lean muscle mass
https://git.itbcode.com/benedictrasco0 valley
https://git.ulabcare.com/berniecetmk297 buy online steroids
http://git.edazone.cn/edwinboelke567 Girl On Steroids
http://www.tdss.website:801/gabrielebaylis steroid injection for
muscle building
https://git.wisder.net/daveharder944 valley
https://inmessage.site/@darciesmond406 oral
steroids for sale online in usa
http://iskame.bg.cm/@mariocann06540 valley
https://www.gitmate.dev/gudrungass0709 Where To Get Steroids From
https://syq.im:2025/bonita87d3524 a likely danger from long term use of steroids includes
https://git.yinas.cn/milanmolino367 valley
https://www.oddmate.com/@sjtshari75303 gnc muscle building
stacks
https://www.enginx.dev/grettaswc1678 top bulking supplements
https://airplayradio.com/finncoombs1322 risks Of using anabolic steroids
https://git.lodis.se/catalinapeden2 dianabol anabolic steroid
https://musixx.smart-und-nett.de/jeremiaha25437 Legal steroids 2019
https://datez.pro/@danniecolmener legal steroids
2014
https://g2.m8il.in/jungmockridge the rock does steroids
https://gitea.sguba.de/londerrick207 valley
http://gitea.wholelove.com.tw:3000/carmapullen516 steroid
substitute
http://git.linkupx.com/charolettekula prednisone side effects after stopping use
https://tunelifystream.com/eldonryrie075 define
steroid hormone
https://code.miraclezhb.com/angelitafoos93 Tren gnc
https://git.cloud.leonclassroom.com/alanaharless72 strongest oral steroid
https://git.rbsx.de/pennyplain220 valley
https://git.ghostpacket.org/diannetorpy653 winstrol before after photos
https://git.alexavr.ru/christinbladen valley
https://git.cloud.leonclassroom.com/alanaharless72 injectable deca
durabolin for sale
https://gitlab.ui.ac.id/galekotai81227 best steroids to get big fast
https://git.outsidecontext.solutions/athenahennessy Shrinking Pills Height
https://git.penwing.org/ajasilas11662 valley
https://git.ultra.pub/caitlyn3813206 physiological effects of steroids
https://gitea.vidoks.fr/danielesprague valley
https://gitea.questline.coop/consuelowicker what are steroids and what are
they used for
Ваши видео с отзывами клиентов такие живые! Заказала розы на Новый год - все соответствовало описанию!
<a href=https://t.me/cvetaevatomskru/30>заказ цветов томск с доставкой</a>
Идеальный букет для учителя!Благодарность в цветах!
<a href=https://svstrazh.forum24.ru/?1-3-0-00000403-000-0-0-1756469890>купить цветы в томске</a>
Букет прибыл с небольшим запасом времени до назначенного срока. Это дало возможность спокойно подготовиться к сюрпризу. Очень ответственно!
<a href=https://cah.forum24.ru/?1-13-0-00002615-000-0-0-1756712428>кустовые розы купить в томске</a>
Как же я вовремя увидела вашу страницу перед 8 Марта! Розы для мамы пришли свежайшими, хотя заказывала в последний момент!
<a href=https://t.me/cvetaevatomskru/392>купить пионы томск</a>
Потрясающие букеты на 8 Марта!Весенне!
<a href=https://cah.forum24.ru/?1-13-0-00002603-000-0-0-1756470315>доставка цветов в томске</a>
Спасибо за идеи с дополнениями к розам! Добавила к букету на 14 февраля мягкую игрушку - получился идеальный подарок!
<a href=https://t.me/cvetaevatomskru/488>купить цветы в томске</a>
https://jobgetr.com/members/yakcow8/activity/43342/ difference between Anabolic
And androgenic
https://gratisafhalen.be/author/helenboy9/ how does the abuse
of anabolic steroids affect teens?
https://aryba.kg/user/sampanspoon43/ safest Bodybuilding
Supplements
https://jobgetr.com/members/cutcoil05/activity/97657/ valley
https://aryba.kg/user/datecare8/ define steroid hormone
https://forum.issabel.org/u/errorspade2 steroids to Lose weight and gain muscle
https://jobgetr.com/members/plainbank5/activity/96557/ Best steroid
like supplements
https://topbookmarks.cloud/item/445665 sus and deca before and after
https://output.jsbin.com/sumekegufu/ winstrol Pre workout
https://myspace.com/flytaiwan56 Valley
https://allmyfaves.com/daybolt5 valley
https://www.samanthaspinelli.it/author/josephheart94/ Steroid injections bodybuilding
https://www.24propertyinspain.com/user/profile/1191999 building muscle steroids
https://motionentrance.edu.np/profile/spearhelium3/ valley
https://vsegda-pomnim.com/user/actormaple3/ is it possible to get big
without steroids
https://intensedebate.com/people/reasonpvc95 Anabolic steroids Long term effects
https://topspots.cloud/item/403007 Legal steroid bodybuilding
https://topbookmarks.cloud/item/404266 most effective steroid for
muscle gain
Ваши курьеры – настоящее лицо компании! Всегда опрятные, вежливые и пунктуальные. Спасибо за такой прекрасный персонал.
<a href=https://svstrazh.forum24.ru/?1-3-0-00000408-000-0-0-1756886292>пионовидные розы Томск</a>
Быстрая доставка на дом!Удобно и пунктуально!
<a href=https://pelsh.forum24.ru/?1-8-0-00000556-000-0-0-1756470049>купить цветы в томске</a>
Ваши видео с отзывами в инстаграм такие искренние! Заказала розы на юбилей свадьбы родителей - все гости восхищались!
<a href=https://t.me/cvetaevatomskru/344>заказать цветы томск</a>
Были сомнения по поводу доставки в другой город, но вы развеяли их все! Отслеживание заказа работало идеально. Всё пришло в срок.
<a href=https://superogorod.ucoz.org/forum/2-4500-1>купить розы в томске</a>
Изумительные каллы!Строгие и стильные!
<a href=https://setter.borda.ru/?1-1-0-00001601-000-0-0-1756469773>букеты томск</a>
Заказывала белые розы для невесты. Они были безупречны! Хрупкие, нежные и очень свежие. Спасибо за помощь в создании прекрасного дня.
<a href=https://automobilist.forum24.ru/?1-5-0-00001685-000-0-0-1756886104>пионовидные розы Томск</a>
Потрясающие нарциссы!Вестники весны!
<a href=https://setter.borda.ru/?1-1-0-00001601-000-0-0-1756469773>купить розы в томске</a>
Как я рада, что нашла ваш аккаунт! Благодаря посту про доставку в выходные смогла заказать розы на субботнюю вечеринку!
<a href=https://www.instagram.com/p/DDraUHZKygw/?img_index=9&igsh=MWNlZjB5Yjd5c2xrZQ==>заказ цветов томск</a>
Ваши видео с праздничными букетами вдохновили на заказ роз с хрустальными подвесками на Новый год - сияли как елочные игрушки!
<a href=https://t.me/cvetaevatomskru/488>заказ цветов томск с доставкой</a>
Как хорошо, что вы показываете разные форматы букетов! Выбрала розы в корзине на 8 Марта - удобно и красиво!
<a href=https://t.me/cvetaevatomskru/378>заказ цветов томск с доставкой</a>
Были сомнения по поводу доставки в другой город, но вы развеяли их все! Отслеживание заказа работало идеально. Всё пришло в срок.
<a href=https://aktivnoe.forum24.ru/?1-9-0-00001253-000-0-0>купить розы в томске</a>
Идеальный букет для бабушки!Она плакала от счастья!
<a href=https://pelsh.forum24.ru/?1-8-0-00000544-000-0-0-1756376575>доставка цветов томск на дом</a>
https://subamtv.com/@lavondickey773?page=about steroids muscle
https://git.fadinglight.cn/chongtorrance5 Clen Steroid
https://www.chaorendata.shop/dorie10255243 Is It Safe To Take
Steroids
https://code.livelike.com/rheaarrowood34 brad castleberry steroids
https://git.appservice.vn/namcurrie67225 legal australian steroids
https://freedost.com/read-blog/42374_anavar-cycle-key-data-and-frequently-requested-questions.html Steroid Listing
https://code.swecha.org/olivasaxton13/1886valley/-/issues/1 what do steroids look like
http://git.rabbittec.com/claytontaverne/valley1991/wiki/Anavar+For+Girls%3A+What+Users+Must+Know which of the following is true about
natural steroids
http://git.yinas.cn/victoriahack2 most effective steroid cycle
https://hub.hdc-smart.com/emiliemobley22 what type of drug is anabolic Steroids
http://git.in.ahbd.net/ebonybradway70 long term anabolic steroid use
https://gogs.melontalk.com.cn/ceceliaboswell Deca Steroid Review
https://quickdate.arenascript.de/@kristyeng0219 what
happens when you stop taking steroids
https://qarisound.com/jesseruse72939 where can i get steriods
https://code.livelike.com/rheaarrowood34 valley
https://truthtube.video/@augustinaselle?page=about extreme lean garcinia
http://www.factory18.cn/filomenabalfe7 burn fat build muscle pill
https://musixx.smart-und-nett.de/alisonwhitcomb alcohol and prednisone
Великолепные ирисы!Элегантные и изысканные!
<a href=https://svstrazh.forum24.ru/?1-3-0-00000401-000-0-0-1756376285>заказать цветы томск</a>
Спасибо за пост про мини-розы в горшочках! Заказала на 8 Марта коллегам - все были в восторге от нестандартного подарка!
<a href=https://t.me/cvetaevatomskru/30>заказ цветов томск</a>
Спасибо за лояльность! Как постоянный клиент, чувствую особое отношение и заботу. Это мотивирует возвращаться снова и снова.
<a href=https://superogorod.ucoz.org/forum/2-4256-1>розы в Томске</a>
Отличный сервис!Быстрая обработка заказа!
<a href=https://cah.forum24.ru/?1-13-0-00002603-000-0-0-1756470315>розы купить в томске</a>
Быстрая доставка в любое время суток!Супер!
<a href=https://cah.forum24.ru/?1-13-0-00002603-000-0-0-1756470315>букеты томск</a>
Спасибо за идеи с двойными сюрпризами! Заказала розы с конфетами на 14 февраля - получился полноценный подарок!
<a href=https://vk.com/wall-61709230_7292>купить пионы томск</a>
Заказывала цветы для важных переговоров. Ваш букет создал сразу нужную, тёплую и доверительную атмосферу. Спасибо за помощь в бизнесе!
<a href=https://severussnape.borda.ru/?1-1-0-00000228-000-0-0-1754294976>купить розы в томске</a>
Спасибо за идеи с сюрпризами внутри букетов! Спрятала в розы на 14 февраля кольцо - сказала "да"!
<a href=https://t.me/cvetaevatomskru/30>заказать цветы томск</a>
Спасибо за пост про мини-букеты! Заказала розы дочкам на 8 Марта - они почувствовали себя взрослыми!
<a href=https://www.instagram.com/p/DDraUHZKygw/?img_index=9&igsh=MWNlZjB5Yjd5c2xrZQ==>заказать цветы томск</a>
Заказывала букет для коллеги на день рождения. Это был самый заметный и элегантный подарок! Теперь вся фирма знает о вашем чудесном сервисе.
<a href=https://cah.forum24.ru/?1-13-0-00002615-000-0-0-1756712428>купить розы в томске</a>
Спасибо за то, что вы есть! Вы делаете мир добрее и красивее, один букет за другим.
<a href=https://aktivnoe.forum24.ru/?1-7-0-00017098-000-0-0-1756713998>пионовидные розы Томск</a>
Великолепные композиции для мероприятий!Богато!
<a href=https://svstrazh.forum24.ru/?1-3-0-00000403-000-0-0-1756469890>розы купить в томске</a>
Спасибо за красивые фото роз в интерьере! Повторила вашу новогоднюю композицию - получилось не хуже, чем у профессионалов!
<a href=https://vk.com/wall-61709230_7286>заказать цветы томск</a>
Быстрая доставка корпоративных заказов!Надежно!
<a href=https://svstrazh.forum24.ru/?1-3-0-00000403-000-0-0-1756469890>доставка цветов</a>
Отличное качество цветов!Стоят уже больше недели!
<a href=https://svstrazh.forum24.ru/?1-3-0-00000403-000-0-0-1756469890>купить цветы в томске</a>
Идеальный способ сказать «я тебя люблю» на расстоянии. Мой парень был тронут до глубины души. Спасибо, что помогаете выражать чувства.
<a href=https://superogorod.ucoz.org/forum/2-4500-1>кустовые розы купить в томске</a>
Ваши советы по выбору размера букета в соцсетях помогли не ошибиться с подарком для начальницы на юбилей!
<a href=https://t.me/cvetaevatomskru/475>доставка цветов томск на дом</a>
<a href=https://setter.borda.ru/?1-1-0-00001601-000-0-0-1756469773>цветы томск</a>
Ваши видео с праздничными букетами вдохновили на заказ роз с хрустальными подвесками на Новый год - сияли как елочные игрушки!
<a href=https://vk.com/wall-61709230_7292>заказать цветы с доставкой в томске</a>
Спасибо за возможность оплатить картой онлайн. Это безопасно и удобно. Не пришлось диктовать данные по телефону.
<a href=https://automobilist.forum24.ru/?1-5-0-00001685-000-0-0-1756886104>белые розы купить томск</a>
Отличное качество цветов!Стоят уже больше недели!
<a href=https://cah.forum24.ru/?1-13-0-00002603-000-0-0-1756470315>доставка цветов томск</a>
Researchers have investigated its effects on muscle tissue, tendons,
ligaments, and even nerve regeneration, as well as its anti-inflammatory actions in various
animal models.
BPC-157 Peptide (10MG)
The 10 milligram dose of BPC‑157 is commonly sold in powder form that
can be reconstituted with bacteriostatic water.
A typical vial contains a single 10 mg charge, which after dilution yields a solution suitable for subcutaneous or intramuscular injection. Users
often prepare a working concentration by mixing the powder with 1
milliliter of sterile water, producing a 10 mg per
milliliter solution that can be aliquoted into smaller syringes for daily
dosing.
When purchasing a 10 mg vial, it is important to verify the supplier’s batch number and expiration date.
The peptide should remain stable in the vial for at least six months when stored at room
temperature, though refrigeration can extend its shelf life further.
Some sellers also offer lyophilized versions that are more convenient
for shipping and storage.
BPC‑157 Peptide Information
The core of BPC‑157’s therapeutic appeal lies
in its remarkable ability to accelerate healing processes.
In preclinical studies, the peptide has been shown to increase
angiogenesis, promote collagen synthesis, and modulate inflammatory cytokines.
Its impact on gut mucosa repair has also been highlighted,
with reports of improved ulcer healing and reduced intestinal permeability.
In terms of pharmacokinetics, BPC‑157 is rapidly absorbed when injected subcutaneously or intramuscularly,
achieving peak plasma concentrations within minutes.
The peptide’s half‑life in animal models ranges from 1 to 2 hours,
but its biological effects can persist for days due
to the cascade of downstream signaling pathways it activates.
Safety data are limited to short‑term studies;
however, no significant adverse events have been reported at doses up to 10
mg per day. Users typically monitor for local injection site reactions and any signs of systemic
discomfort. Because BPC‑157 is not yet approved by major regulatory agencies, the peptide is classified
as a research chemical, which necessitates careful handling and adherence to quality standards.
FORM
The form in which BPC‑157 is sold can vary between suppliers, but the most common options
include:
Powdered Peptide Vials – These contain the dry peptide that
must be reconstituted with a sterile diluent before use.
The powder is usually supplied as a single 10 mg charge and is packaged in amber
glass vials to protect against light degradation.
Lyophilized Powder – Freeze‑dried peptides offer greater stability during transport.
Users can add bacteriostatic water directly to the vial, creating an injectable solution on demand.
Pre‑Reconstituted Solutions – Some vendors provide ready‑to‑use syringes
with a fixed concentration (often 5 mg per milliliter).
This format eliminates the need for dilution but may be more expensive and less flexible in dosing adjustments.
Bulk Batches – For laboratories or researchers needing
larger quantities, bulk purchases allow for custom reconstitution and aliquoting according to experimental
protocols.
When selecting a form, consider factors such as storage conditions, convenience, and cost.
The powder and lyophilized options generally offer the best balance of purity and longevity,
whereas pre‑reconstituted solutions are suitable for immediate use in clinical or field settings where time is critical.
In summary, buying BPC‑157 at a 10 mg dose involves choosing a
reputable supplier that provides clear batch information and choosing between powder, lyophilized,
or pre‑reconstituted forms. Understanding the peptide’s regenerative profile,
dosing strategy, and storage requirements will help users maximize its potential benefits while
maintaining safety.
http://git.4taps.me:3000/tracyvivier317 how long is a dianabol cycle
https://git.mdp.edu.ar/jermainej6346 valley.md
https://workposting.com/read-blog/26592_arnold-schwarzeneggers-steroi-more-plates-more-dates.html what to take after dianabol cycle
http://saromusic.ir/philipsellars5 dianabol Cycle benefits
https://git.berfen.com/siobhanloe541 tren dianabol test cycle
https://git.anibilag.ru/sheritadingle4 valley.md
https://silatdating.com/@stantonmarsden testosterone dianabol cycle
https://git.vhdltool.com/reginaldmack69 sustanon dianabol cycle
https://git.lmskaran.com/mariettamadsen dianabol only cycle reddit
https://music.shaap.tg/buckfedler2288 dianabol first cycle
https://forum.alwehdaclub.sa/read-blog/23393_deca-durabolin-cycle-for-beginners-only-or-with-test.html dianabol test
cycle
https://hipstrumentals.net/ankewalthall84 how to take dianabol cycle
https://pokesoul.com/@lanoramoreau37 dianabol winstrol cycle
https://qdate.ru/@honghaley4978 sustanon deca dianabol cycle
https://git.fandiyuan.com/torrifry06018/valley5353/wiki/Dbol-Dianabol-Cycle%3A-How-Strong-Is-Methandrostenolone%3F dianabol cycle
https://successcircle.online/read-blog/6523_dianabol-cycle-faqs-and-harm-reduction-protocols.html Steroid dianabol cycle
https://www.besolife.com/@jonpridham514 Test And Dianabol
cycle
https://gitlab.innive.com/jannettegarcia Dianabol Cycle
For beginners
Стирка одежды с удалением запаха табака проведена успешно! Вещи свежие!
<a href=https://uborka-26.ru/>уборка снега</a>
https://git.epochteca.com/mileshargrave/valley5766/-/issues/1 best dianabol cycle
https://git.siin.space/traceyhodgson8 dianabol cycle
https://gogs.mneme.dedyn.io/carlo41c54897 what to take with
dianabol cycle
https://www.allorpoth.com/read-blog/19315_the-heart-of-the-internet.html Valley.Md
https://nuhweh.com/landondow04327 testosterone and dianabol cycle
https://gitea.coderpath.com/arliedamon475 Best Dianabol Cycle
http://dgzyt.xyz:3000/lurlenedun396 Dianabol Cycle Only
https://blkbook.blactive.com/read-blog/42683_deca-durabolin-cycle-for-beginners-only-or-with-test.html dianabol deca Cycle
https://gitea.codedbycaleb.com/anitrahorst764/3673best-cutting-cycle-stack/wiki/Dbol-Pills-Benefits-In-2025%3A-Muscle-Growth%2C-Dosage-%26-Safe-Use-Guide dianabol primobolan cycle
https://devkona.net/poppyhobbs0633 dianabol side effects after
one cycle
https://gogs.yinbin.ink:8/georgiananemet Valley.Md
https://hgngit.ipdz.me/ctzfran3164609 Testosterone Dianabol Cycle
http://ancientsmedia.com/read-blog/5574_dbol-dianabol-cycle-how-strong-is-methandrostenolone.html dianabol 10mg cycle
https://git.dihe.moe/tayla244628116 dianabol cycle for Beginners
https://supardating.com/@bertnester8014 what to take with dianabol cycle
https://git.svidoso.com/cliffellison32 dianabol only
cycle reddit
https://wp.5173.com/estelledewitt dianabol and testosterone cycle
https://www.lizyum.com/@warrennaumann0 dianabol
and winstrol cycle
https://heylloow.com/@barbdyson8057 dianabol Cycles
https://git.tordarus.net/denicetancred dianabol testosterone cycle
https://biklink.com/read-blog/5296_buy-dianabol-dbol-pills-2025-d-bal-benefits-amp-dosage-guide.html dianabol deca cycle
https://git.rokiy.com/jadekulikowski dianabol post Cycle
http://woorichat.com/read-blog/86789_dbol-dianabol-cycle-how-strong-is-methandrostenolone.html sustanon and Dianabol Cycle
http://git.modelhub.org.cn:980/jeremyoneal531 dianabol And
Testosterone cycle for beginners
https://music.magic-pics.tk/justin0381966 anavar and dianabol cycle
https://git.auwiesen2.de/carissajiron48 dianabol deca test cycle
https://www.besolife.com/@winonasholl489 valley.Md
https://git.suika.org/carencurnow008 dianabol post cycle
http://hualiyun.cc:3568/borissilvis796 how long is a dianabol cycle
http://woorichat.com/read-blog/86789_dbol-dianabol-cycle-how-strong-is-methandrostenolone.html dianabol side effects after one cycle
https://git.yuhong.com.cn/lucienneweinma best Dianabol cycle
https://git.pingupod.de/gretatomholt6 dianabol and testosterone cycle
For Beginners
https://www.allorpoth.com/read-blog/19316_what-should-i-expect-from-a-dianabol-only-cycle-without-a-test-base-be.html dianabol steroid cycle
https://gitea.synapsetec.cn/rodgerkmw4857 Valley.Md
https://gogs.kakaranet.com/melvingeorgina Valley.md
https://m.hrjh.org/bettinastrode dianabol cycle only
https://www.jimmyb.nl/cniangel402485 Sustanon And Dianabol Cycle
https://www.aservicehost.ru/collinshanahan/5229350/wiki/Test-Deca-Dbol-Cycle-What-Are-The-Effects%3F Dianabol steroid cycle
https://schokigeschmack.de/lelamoeller88 Valley.Md
http://gitea.shundaonetwork.com/martalaver3852 valley.md
https://git.tea-assets.com/candacebeckett dianabol test e cycle
https://gitea.quiztimes.nl/ethanlions2610 testosterone cypionate and dianabol cycle
http://libochen.cn:13000/joiesoukup027 oral dianabol cycle
https://git.smartenergi.org/essiecarey994 dianabol dosage cycle
https://workposting.com/read-blog/26592_arnold-schwarzeneggers-steroi-more-plates-more-dates.html dianabol cycle dosage
https://isabelzarate.com/edwardodominiq what to take
after dianabol cycle
https://twittecx.com/read-blog/326_anabolic-steroids-what-they-are-uses-side-effects-amp-risks.html dianabol test cycle
https://git.memosnag.com/paulettestaple best dianabol cycle
http://sh.frp.one:32189/buford99589661 4 week dianabol cycle
https://git.powerdata.dk/hildegardeu80 dianabol and testosterone cycle for beginners
https://git.tea-assets.com/candacebeckett Testosterone
trenbolone dianabol Cycle
https://gitea.adminakademia.pl/ouidal83971258 testosterone trenbolone dianabol cycle
https://git.51aspx.com/edwinhuckstep4 dianabol dosage cycle
http://ggzypz.org.cn:8664/bqgdorie95651/valley1990/wiki/Dbol+Dianabol+Cycle%253A+How+Strong+Is+Methandrostenolone%253F test dianabol cycle
https://virnal.com/@bereniceprerau?page=about dianabol cycle
reddit
https://hiphopmusique.com/virgilrankin68 dianabol testosterone cycle
https://git.nightime.org/hershel54s8353 post cycle therapy for dianabol
https://freedost.com/read-blog/56549_poster-keerthana-deepti-karunakaran-biomedical-engineering-and-imaging-institute.html valley.md
https://bez2.ru/@ilatorgerson13?page=about dianabol side Effects after one cycle
http://oa.sccehui.com:6101/nataliebox1399 dianabol cycle side effects
http://aimusicitalia.it/jeffhanton1493 valley.md
https://bluebirdmusic.in/@tosjere1171416?page=about winstrol dianabol cycle
https://www.shopes.nl/ulrikemoyer85 Dianabol Only Cycle For Beginners
https://mobishorts.com/@mikaylavanzett?page=about injectable dianabol cycle
https://mardplay.com/antoinettefrit dianabol first cycle
https://twingface.com/read-blog/302_dianabol-cycle-faqs-and-harm-reduction-protocols.html Test e And dianabol Cycle
https://git.rikkei.edu.vn/claudioquinn97 valley.md
https://code.miraclezhb.com/katherinecarr dianabol first cycle
https://hipstrumentals.net/jeanameier0855 valley.md
https://git.burokratgroup.ru/sunnya25328321 testosterone dianabol cycle
https://csmtube.exagopartners.com/@arao4603604598?page=about valley.Md
https://www.beyoncetube.com/@arronbarcenas0?page=about dianabol And Anavar Cycle
https://www.nemusic.rocks/hannasauceda66 https://www.nemusic.rocks/hannasauceda66
https://www.lab.justusdeitert.de/darrengoldfinc/darren2021/-/issues/1 www.lab.justusdeitert.de
https://gitea.xy88.fun/nolavarghese87 https://gitea.xy88.fun/
https://gitea.aetoskia.com/rosella28x8643 gitea.aetoskia.com
https://movieplays.net/@vallietidwell?page=about movieplays.net
http://git.2weisou.com/paulinafolse9 http://git.2weisou.com/paulinafolse9
https://gitea.shirom.me/fplcandice4307 https://gitea.shirom.me
https://wtube.net/@luisbaker73512?page=about https://wtube.net/
https://gofleeks.com/read-blog/667_deca-durabolin-uses-benefits-and-side-effects.html gofleeks.com
https://git.raiseyourjuice.com/edmundodunlop git.raiseyourjuice.com
http://www.danyuanblog.com:3000/darcyhowe94042 http://www.danyuanblog.com:3000/darcyhowe94042
https://milisto.com/read-blog/14276_bulking-cycle-10-weeks-pdf.html https://milisto.com/read-blog/14276_bulking-cycle-10-weeks-pdf.html
https://ltube.us/@chariskirkpatr?page=about ltube.us
http://git.7doc.com.cn/meaganmercier git.7doc.com.cn
https://code.openmobius.com:3001/gerardoiyv2997 https://code.openmobius.com:3001/gerardoiyv2997
https://aipod.app/lakeishaamador aipod.app
http://nas.bi1kbu.com:8418/cindafitzsimon nas.bi1kbu.com
https://git.lucas-michel.fr/rodrigobunker5 https://git.lucas-michel.fr/
https://gogs.melontalk.com.cn/lillavann41007/lilla1986/wiki/Dianabol+Cycle+For+Perfect+Results%253A+The+Preferred+Steroid+Of+Titans gogs.melontalk.com.cn
https://gitea.ideaopen.cn/kenthartz14844 https://gitea.ideaopen.cn
https://tv.kabarwarga.com/@margheritab61?page=about https://tv.kabarwarga.com
http://digitalcommerce.cloud/gidgetdollar62 digitalcommerce.cloud
http://git.ibossay.com:3000/jeniferwestgar git.ibossay.com
http://a21347410b.iask.in:8500/dorothybarunga a21347410b.iask.in
https://git.mopsovi.cloud/casiealarcon59 https://git.mopsovi.cloud/casiealarcon59
http://www.huastech.com.cn:81/elissa69774424/gitea.ucarmesin.de4711/wiki/Maximize-Gains:-Effective-Dbol-Tren-Cycle-For-Bodybuilders www.huastech.com.cn
https://gitea.offends.cn/alannahcrombie gitea.offends.cn
https://gogs.dev.dazesoft.cn/opalnakamura47 https://gogs.dev.dazesoft.cn/opalnakamura47
http://woorichat.com/read-blog/113871_dianabol-for-sale-effectivity-and-regulation.html woorichat.com
https://gitlab.rightease.com:443/leahdeitz0430/git.taglang.io1994/-/issues/1 https://gitlab.rightease.com
https://git.9ig.com/caroleedkins4/5583132/wiki/Dianabol-Cycle%3A-FAQs-And-Harm-Reduction-Protocols https://git.9ig.com
https://echbar.online/alinejuan5248 echbar.online
https://www.youtoonetwork.com/youtootube/@horace05q0784?page=about www.youtoonetwork.com
https://git.yangzhiqiang.tech/bettinaluna47 git.yangzhiqiang.tech
https://g.ovlg.com/celsanormanby g.ovlg.com
https://git.mklpiening.de/nydiatait51387/nydia2018/wiki/Dianabol-At-10mg-A-Day git.mklpiening.de
https://khmerhd.tv/@jeanettflc5022?page=about khmerhd.tv
https://movieru.jp/portfolio/@donhwn0440208?page=about https://movieru.jp
https://git.simbarbet.com/rickeyhux37725/git0.zpqrtbnk.net1985/wiki/Dbol-Dianabol-Cycle%3A-How-Strong-Is-Methandrostenolone%3F git.simbarbet.com
https://afrikaners.org/read-blog/6176_dianabol-cycle-faqs-and-harm-reduction-protocols.html afrikaners.org
http://gitea.liaozhuangkeji.com/stephanytreloa http://gitea.liaozhuangkeji.com/stephanytreloa
https://www.shopes.nl/franciscolink0 https://www.shopes.nl/
https://gog.taletrail.fi/lacytse6759485 gog.taletrail.fi
https://bexopro.com/read-blog/44801_dianabol-10-mg.html https://bexopro.com/read-blog/44801_dianabol-10-mg.html
https://www.monasticeye.com/@linwoodmaher40?page=about www.monasticeye.com
http://malingshu.site:6010/katiascholz642 malingshu.site
https://tubechretien.com/@jeramysorlie01?page=about https://tubechretien.com/
https://likenchat.in/read-blog/4028_trenbolone-vs-dianabol-are-they-safe.html https://likenchat.in
https://gogs.gaokeyun.cn/damionbenner2 gogs.gaokeyun.cn
https://forum.petstory.ge/read-blog/32528_dbol-cycle-guide-to-stacking-dosages-and-side-effects.html forum.petstory.ge
https://www.canaddatv.com/@faamaribel0734?page=about https://www.canaddatv.com/@faamaribel0734?page=about
https://sing.ibible.hk/@derrickleibius?page=about sing.ibible.hk
https://git.bigtravelchat.com/jonahpaschke30 git.bigtravelchat.com
http://git.jiankangyangfan.com:3000/marielooney761 http://git.jiankangyangfan.com:3000/marielooney761
https://git.bigtravelchat.com/joycelynoctoma Dianabol Cycle dosage
http://youplay.az-solutions.pk//@lestercram7898?page=about oral dianabol cycle
https://dhivideo.com/@caitlynmarrone?page=about dianabol cycle chart
http://minimoi.mynetgear.com:3000/lamont64166188 test
and dianabol cycle
https://www.atmasangeet.com/lavonpriest831 Testosterone And Dianabol Cycle
https://repo.apps.odatahub.net/laynegellatly valley.Md
http://git.yinas.cn/chana19h558083 dianabol 10mg cycle
https://bc-devops-gitea.digiwincloud.com.cn/valentintazewe tren dianabol test cycle
https://easyconnect.fun/@brentoncurran sustanon and dianabol
cycle
http://provision-sa.co.za:3000/andrepeake4001 dianabol only cycle results
http://git.2weisou.com/charlineberlin testosterone dianabol cycle
http://www.shqkxh.org:3000/leonorestrothe dianabol winstrol cycle
https://gogs.zeusview.com/aracelybaumgae/aracely1992/wiki/Why+Bodybuilders+Love+Dianabol+PPT+Hormonal+Disorders+Endocrine+And+Metabolic+Diseases Dianabol Injection Cycle
https://git.westeros.fr/lasonyakellihe test deca dianabol cycle
https://ubuntushows.com/@sharihindmarsh?page=about Valley.md
http://gitea.ucarmesin.de/elizbethavelar/1073ajarproductions.com/wiki/The-Heart-Of-The-Internet Valley.Md
https://suksesvol.org/read-blog/67799_first-steroid-cycle-best-steroids-for-muscle-growth-before-and-after-result-ster.html Valley.md
https://ljs.fun:19000/nellyrobillard/9594mlx.su/wiki/Dianabol-Vs-Anavar%3A-Which-Steroid-Is-Right-For-You%3F dianabol cycle for beginners
https://www.nenboy.com:29283/louveniaweisz dianabol 6
week cycle
https://repo.komhumana.org/ejpverla06663 dianabol cycle results
http://gitlab.wkcoding.com/jinamarquis377 dianabol cycle
https://git.fadinglight.cn/lesleyweathers Dianabol cycle
reddit
https://dev.dhf.icu/consuelozvk27/consuelo2024/wiki/5-Best-Anabolic-Stacks-And-Steroids-For-Beginners Valley.md
https://git.srv.ink/michelesoundy0 valley.md
https://alumni.myra.ac.in/read-blog/438156_dianabol-cycle-guide-from-beginner-to-advanced-cycling-without-the-bloat-plus-re.html Valley.Md
http://gitea.yunshanghub.com:8081/senaidaf485634 Deca dianabol cycle
https://git.winscloud.net/chantetressler dianabol post cycle
therapy
http://www.dchain-d.com:3000/torstenconrad2 dianabol cycle before and after
https://git.crudelis.kr/chrislanders41 dianabol test e cycle
https://gitea.tryinvisia.us/berylcmq74207 winstrol and dianabol cycle
https://www.makerscommons.eu/gitlab/virginiakable/virginia2019/-/issues/1 dianabol and testosterone cycle for beginners
https://poptop.online/read-blog/12361_deca-durabolin-uses-benefits-and-side-effects.html dianabol cycle benefits
https://git.healthathome.com.np/vbnjohn953152 dianabol only cycle
https://diamondbellaministry.org/resources/@scottykenney86?page=about dianabol winstrol Cycle
http://hualiyun.cc:3568/brycebriseno02 How To Take Dianabol First Cycle
https://bc-devops-gitea.digiwincloud.com.cn/jan25e38849688/skitterphoto.com2009/wiki/Dianabol-8R%2C9S%2C10S%2C13S%2C14S%2C17S-17-hydroxy-10%2C13 dianabol steroid cycle
https://git.thweb.net/elmopalacios44 dianabol injection cycle
https://deltasongs.com/briannesaywell Valley.Md
https://speeddating.co.il/@sommer22f02406 dianabol only cycle results
https://quickdate.click/@theo6668524932 valley.md
https://service.ananops.com/stevemolnar928/ajarproductions.com1991/wiki/Beginner+Steroid+Cycles dianabol cycle guide
https://gitea.mocup.org/denishakwb1694 dianabol injection cycle
https://milisto.com/read-blog/14353_dianabol-cycle-faqs-and-harm-reduction-protocols.html testosterone enanthate and dianabol cycle
https://tunelifystream.com/jeremynellis4 dianabol 6 week cycle
https://schsocial.com/read-blog/17135_dianabol-cycle-guide-from-beginner-to-advanced-cycling-without-the-bloat-plus-re.html dianabol
and testosterone cycle
https://bantooplay.com/@sheldonmcdouga?page=about how long
is a dianabol cycle
https://worship.com.ng/keenanlund3412 Valley.md
https://git.epochteca.com/jettpatino4615 dianabol and
deca cycle
http://rm.runfox.com/gitlab/ionaeades4896 how to cycle dianabol
https://www.cloud.file.futurestack.cn/stellahowey55 dianabol only cycle reddit
https://xajhuang.com:3100/rosa20w433576 dianabol
cycle chart
https://git.winscloud.net/rafaelabarbour deca dianabol test cycle
http://git.pushecommerce.com/lesleebourke72/leslee1989/wiki/Oral-Vs-Injectable-Steroids:-How-Long-Do-Steroids-Stay-In-Your-System%3F beginner dianabol
cycle
http://www.tm-jikayo.com:8081/angelineopas80 Valley.Md
https://nrimatchmaking.com/@jenniferhender dianabol cycle guide
http://dev.hsfuel.com:3000/tedshuster7941 dianabol testosterone Cycle
http://demo.sunflowermachinery.com/scothammons78 Dianabol Cycle Side Effects
https://heylloow.com/@olgai548866223 Valley.Md
https://gitea.svc.obaa.cloud/kaymccreary637 deca dianabol cycle
http://www.tm-jikayo.com:8081/angelineopas80 dianabol And winstrol cycle
https://vxtube.net/@emiloleary355?page=about Valley.Md
https://connect.mopays.com/read-blog/22242_dianabol-cycle-guide-dbol-dosage-timing-for-best-result.html What
to take with dianabol cycle
https://matchmingle.fun/@alizaprisco178 dianabol only cycle
http://chengchennet.cn:3000/clarkcolechin valley.md
https://tubevieu.com/@earleormond94?page=about dianabol cycle side effects
https://volts.howto.co.ug/@leticiamcdanie dianabol only cycle reddit
http://nas.killf.info:9966/kellileeds4371 dianabol 50mg cycle
https://gitlab.innive.com/jettsandoval28 valley.md
https://afroconnected.com/read-blog/1882_dianabol-cycle-faqs-and-harm-reduction-protocols.html 4
week dianabol cycle
https://git.micahmoore.io/francinemeiner anavar dianabol cycle
https://ouptel.com/read-blog/154747_pdf-dianabol-unveiled-a-systematic-review-of-methandrostenolone.html dianabol sustanon cycle
https://qodwa.tv/@oxwshanice1096?page=about testosterone trenbolone dianabol cycle
https://git.simbarbet.com/ellistie653814 dianabol cycle
Dosage
https://homeview.emmcoc.com.ng/@tobyycw1280519?page=about dianabol test
e cycle
https://yooverse.com/@samaraharbison Valley.md
https://git.simbarbet.com/ellistie653814 dianabol first cycle
https://date4you.de/@lazarogaddis86 what to take after dianabol cycle
https://bondlii.com/@sandray4920995 Dianabol Cycles
https://git.palagov.tv/danieladmu0829 testosterone dianabol cycle
https://smusic.sochey.com/rosalynkellway testosterone dianabol cycle
https://gogs.zeusview.com/jereesmond779 beginner dianabol cycle
https://git.fhlz.top/sofiamathis703 dianabol cycles
https://kition.mhl.tuc.gr/muujoni8040830 valley.md
https://artbeninshow.afiganmey.com/wyattshinn3547 dianabol and deca cycle
https://mybeautytube.tv/@giselepina4373?page=about Dianabol Test Cycle
https://git.slurm.ch/gilda97987982 dianabol cycle guide
https://karabass.pro/@noahschnaars95?page=about Valley.md
https://mybeautytube.tv/@jacklynt180120?page=about Valley.Md
https://intimsync.com/alberthafalk66 dianabol cycle dosage
https://gogs.playpoolstudios.com/roxanalantz13 dianabol only cycle reddit
https://repo.komhumana.org/arlette68d0765 repo.komhumana.org
https://git.moguyn.cn/leonay52556264 git.moguyn.cn
https://git.schoonbaert.net/cdnjovita23032 git.schoonbaert.net
https://www.arabianmatrimony.com/@aleidalemberg4 https://www.arabianmatrimony.com/
https://git.yuhong.com.cn/candramanson8 git.yuhong.com.cn
https://git.bigtravelchat.com/cliffordhite4 https://git.bigtravelchat.com/cliffordhite4
https://git.haowuan.top/corneliusfrank git.haowuan.top
https://git.wun.im/alfredsemmens4 https://git.wun.im/alfredsemmens4
http://ruofei.vip/maryellen16c25 ruofei.vip
https://git.ides.club/clementcarone7 git.ides.club
https://rearch.engineer/dannyym014783 https://rearch.engineer/
https://www.alex-hatsu.ru/elliotmanning www.alex-hatsu.ru
http://git.7doc.com.cn/marcelhyland08 git.7doc.com.cn
https://git.bloade.com/darren70603289 git.bloade.com
https://www.jccer.com:2223/floydagostini https://www.jccer.com:2223/floydagostini
https://alm.pragmatismo.com.br/crystlemav848 https://alm.pragmatismo.com.br/crystlemav848
https://git.lakaweb.com/anneouellette8 git.lakaweb.com
https://git.bayview.top/codyjasso6133 git.bayview.top
https://git.arachno.de/samaratiller14 valley.md
https://gitstock.zhuishuyun.com/berrymiles7026 Valley.md
https://gitea.vidoks.fr/dinofredericks Valley.Md
https://www.onlywam.tv/@montyhaggerty5?page=about winstrol
dianabol cycle
https://git.fhlz.top/ezekielwebber8 best dianabol cycle
https://alfaqeerbroadcast.com/read-blog/29674_anavar-cycle-key-information-and-frequently-asked-questions.html Sustanon deca
Dianabol cycle
https://elitetier.club/read-blog/2448_dianabol-with-trt.html testosterone enanthate
and dianabol cycle
http://server.ayaojies.com.cn:3000/miriam40097978 dianabol cycle
chart
https://chinami.com/@thelmaejo47389?page=about valley.md
https://greektalks.site/read-blog/10298_5-best-anabolic-stacks-and-steroids-for-beginners.html dianabol steroid cycle
https://artbenshow.com/edenmerrell674 valley.md
https://tubevieu.com/@rubinpool07838?page=about injectable dianabol cycle
https://git.z1.mk/olen2058697468 valley.Md
https://tiktoksi.com/read-blog/276_dianabol-tablets-essential-guide-for-first-time-buyers-and-safe-usage.html Oral
dianabol Cycle
https://www.shopes.nl/arnoldbaird722 4 week dianabol cycle
https://elitetier.club/read-blog/2441_the-heart-of-the-internet.html dianabol cycle
for beginners
https://gogs.spbda.ru/taniapellegrin/7515914/wiki/Dotcom+On+Steroids+GQG+Partners Valley.Md
https://jaschka.com/@mitchhart42812?page=about dianabol and testosterone cycle for beginners
https://golz.tv/@kaylayhj10069?page=about Valley.Md
http://repo.bpo.technology/francescaolive best dianabol cycle
https://ai.holiday/read-blog/55666_trenbolone-dianabol-stack-to-build-mass-amp-strength.html valley.md
https://startuptube.xyz/@rodvance211830?page=about valley.md
https://gogs.mneme.dedyn.io/woodrowcalhoun beginner dianabol cycle
https://matchmingle.fun/@lavonkissner01 dianabol Cycles
https://nuhweh.com/matthewgrattan deca dianabol test cycle
https://gitlab.tu-dortmund.de/albertinagerri dianabol anavar cycle
https://gogs.gaokeyun.cn/aleciatorpy11 dianabol side effects after one cycle
https://bantooplay.com/@sheldonmcdouga?page=about dianabol cycle chart
https://xajhuang.com:3100/adelly9083476 dianabol and testosterone Cycle For
beginners
http://www.cnbluechip.com/kristyatf32820 dianabol winstrol cycle
http://git.xh666.net/alanacarmichae testosterone cypionate and dianabol cycle
https://gitlab.rightease.com:443/lukehowden363 Dianabol 50mg Cycle
https://gitea.potatox.net/elisedarker779 dianabol and testosterone cycle for beginners
https://git.emanuelemiani.it/vivienchestnut testosterone trenbolone dianabol cycle
https://git.kukharuk.ru/lethashanks790 sustanon deca dianabol
cycle
https://www.zapztv.com/@jorgdurr53436?page=about steroid dianabol
cycle
https://gitlab.healthcare-inc.com/colleencarlos3/colleen2013/-/issues/1 dianabol Only Cycle reddit
https://git.cydedu.com/yasmink029858 dianabol cycle
for beginners
https://icstepup.com/read-blog/5583_tren-e-test-amp-dianabol-bodybuilding-forum.html testosterone and dianabol cycle
http://energonspeeches.com/@ediththao39093?page=about testosterone dianabol
Cycle
https://homeablazebyhispresence.dennmachinery.com/@aguedax1768540?page=about Valley.Md
https://code.swecha.org/namdulaney5670/3766iotpractitioner.com/-/issues/1 Valley.Md
https://www.xn--b1agaaane1bc1av8e.xn--p1ai/ronaldthrossel dianabol cycle results
https://massivemiracle.com/@jaibromby5623?page=about dianabol deca cycle
https://mystdate.com/@hoseavgj53958 Valley.md
https://www.tmip.com.tr/@ybomaggie11402?page=about what to take after
dianabol cycle
https://voicync.com/samira0683199 dianabol injection cycle
https://cash.com.tr/@kelleemontero8?page=about First Dianabol cycle
https://gitea.cloudfindtime.com/irenet49693259 valley.md
https://usvs.ms/read-blog/21756_beginners-anabolic-cycle.html valley.md
https://gitlab.companywe.co.kr/imogenegregory testosterone trenbolone dianabol cycle
https://gitea.irons.nz/daniellowery5 dianabol dosage cycle
http://www.huastech.com.cn:81/shannamcnabb9 dianabol oral cycle
https://git.ides.club/augustinabergm anavar and dianabol cycle
https://git.prime.cv/eliashzi843215/elias2013/wiki/Dianabol+Cycle%253A+FAQs+And+Harm+Reduction+Protocols dianabol primobolan cycle
https://git.rbsx.de/garfieldsolori valley.md
https://gitea.potatox.net/elisedarker779 dianabol cycle length
https://homeablazebyhispresence.dennmachinery.com/@jerrodguffey1?page=about dianabol Sustanon cycle
https://gitea.tryinvisia.us/berylcmq74207 beginner Dianabol Cycle
https://gogs.alexwild.it/brentonplace75 how to take dianabol first cycle
https://service.ananops.com/rpdgrover34567 dianabol steroid cycle
https://familyworld.io/@annettf0653463?page=about Valley.Md
http://boiler.ttoslinux.org:8888/winnievanguild dianabol
and test cycle
https://gitea.jasonstolle.com/corazonspradli Dianabol beginner cycle
https://simapodcast.co.ls/@ericka54579760?page=about testosterone enanthate and Dianabol cycle
https://feelingspot.com/read-blog/3040_dianabol-injectable-for-sale-usa-domestic-and-worldwide-shipping.html valley.md
https://git.mryao.cc/wilmermachado6/duvidas.construfy.com.br1980/wiki/Deca-Durabolin+Nandrolone%253A+The+Ultimate+Guide Dianabol cycle dosage
https://afromonsta.com/reneepinkney94 valley.md
https://gogs.zeusview.com/alexandracooke dianabol and anavar cycle
https://git.sayndone.ru/almalockyer574 Dianabol cycle
results
https://social.instinxtreme.com/read-blog/109478_dianabol-dbol-cycle-best-options-for-beginners-and-advanced-users.html Valley.Md
http://lssnas.tk:10880/conradvest5404 dianabol
cycle dosage
http://woorichat.com/read-blog/121165_anabolic-steroids-uses-side-effects-and-alternatives.html valley.md
http://dgzyt.xyz:3000/jesenia813048 dianabol 50mg cycle
http://demo.sunflowermachinery.com/dorishaggerty dianabol and deca
cycle
https://git.juici.ly/margie46503524 dianabol only
cycle results
http://git.youkehulian.cn/reynaschirmeis Valley.md
https://deaddeaddead.store/rachelkawamoto dianabol anavar cycle
https://learninghub.fulljam.com/@desireeguffey0?page=about valley.md
https://gitea.thanh0x.com/dorcasw5706513 dianabol post cycle therapy
https://ugossiptalk.site/read-blog/34_a-systematic-review-of-methandrostenolone.html tren dianabol test cycle
https://communiti.pcen.org/read-blog/29976_first-steroid-cycle-beginners-guide-to-safe-steroid-cycling.html dianabol post cycle
https://dev.fleeped.com/read-blog/62483_5-best-anabolic-stacks-and-steroids-for-beginners.html Dianabol And Testosterone
Cycle For Beginners
https://lovematch.vip/@shauntefeuerst valley.md
http://platform.wookitech.com:3000/frankreddall8/4852011/wiki/Dianabol+Cycle+For+Perfect+Results%253A+The+Preferred+Steroid+Of+Titans dianabol And test cycle
https://wiwonder.com/read-blog/51003_dianabol-cycle-dianabol-for-bodybuilding.html dianabol 50mg cycle
https://newsflip.in/@rollandwpu8189?page=about testosterone cypionate and dianabol cycle
https://i.megapollos.com/@kathyhuondeker?page=about how to cycle dianabol
http://www.zjzhcn.com/refugiagalvin how to take dianabol first cycle
https://git.mryao.cc/shawneesanchez winstrol dianabol cycle
https://git.the-kn.com/deboral0285287 git.the-kn.com
https://djtime.ru/kristinsheil1 djtime.ru
https://gitea.cybs.io/berthamurdock gitea.cybs.io
https://www.kornerspot.com/@claudiotindall https://www.kornerspot.com/@claudiotindall
http://git.edazone.cn/marie444781294 http://git.edazone.cn/marie444781294
http://gite.limi.ink/clemmiebeaudoi http://gite.limi.ink/
https://naijasingles.net/@koreytai757616 https://naijasingles.net/
https://gitea.eggtech.net/bereniceewan5 https://gitea.eggtech.net/bereniceewan5
https://git.juici.ly/bradlydennys35 https://git.juici.ly
https://audioedu.kyaikkhami.com/adellhermann0 audioedu.kyaikkhami.com
https://www.trappmasters.com/claricesturm7 www.trappmasters.com
https://deltasongs.com/edmundhiw07746 deltasongs.com
http://gite.limi.ink/clemmiebeaudoi gite.limi.ink
https://git.nosharpdistinction.com/aleciaschiassi https://git.nosharpdistinction.com/
https://www.besolife.com/@aldaromano0680 www.besolife.com
https://platform.giftedsoulsent.com/dominiknewbigi https://platform.giftedsoulsent.com
https://nas.zearon.com:2001/brodie35488926 https://nas.zearon.com/
https://hore-i-steigen.jimmyb.nl/antoniettanort hore-i-steigen.jimmyb.nl
https://worldclassdjs.com/evandiggs7908 winstrol and dianabol cycle
https://auntybmatchmaking.com/@manualwight59 deca
and dianabol cycle
https://hekus.pl/gogs/roxannamccrea Valley.Md
https://i10audio.com/claribelruby71 dianabol post cycle therapy
http://git.datanest.gluc.ch/shaunteuug2190 dianabol and testosterone cycle
https://mp3diary.com/luzedye9041498 how to Take dianabol cycle
http://git.7doc.com.cn/susanjelks2818/1954089/wiki/5-Best-Anabolic-Stacks-And-Steroids-For-Beginners Valley.Md
https://community.gamersvision.nl/read-blog/37829_the-heart-of-the-internet.html testosterone trenbolone dianabol cycle
https://gitea.alaindee.net/houstonserrano steroid dianabol cycle
https://git.rikkei.edu.vn/charlotteholly tren dianabol test cycle
https://matchmadeinasia.com/@susankinard366 testosterone trenbolone dianabol cycle
https://git.atomos.io/ameereading562 dianabol And deca Cycle
https://gwiremusic.com/kelleburdett56 dianabol stack cycle
https://git.ellinger.eu/jestinedobson dianabol test e cycle
https://tubechretien.com/@kerry56n15733?page=about dianabol side effects after one cycle
https://qrew.social/read-blog/8851_primo-steroid-metenolone-enanthate-primobolan-cycle-dosage-and-side-effects.html dianabol and
test cycle
https://explore.seaventur.com/read-blog/10521_dianabol-cycle-pharma-trt.html dianabol primobolan cycle
https://kifftondate.com/@laurensear7316 post cycle therapy
for dianabol
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/peppercondor4/ https://--7sbarohhk4a0dxb3c.рф/user/peppercondor4/
https://walletwedge24.werite.net/optimizing-performance-with-a-structured-dianabol-regimen walletwedge24.werite.net
https://telegra.ph/Stanozolol-Winstrol-Cycle-Overview-Advantages-and-Potential-Side-Effects-Explored-10-08 telegra.ph
https://www.sbnation.com/users/hyde.pape sbnation.com
https://badcase.org/zygg/members/canoefelony7/activity/1263656/ https://badcase.org/
https://support.mikrodev.com/index.php?qa=user&qa_1=meterstreet79 support.mikrodev.com
https://farangmart.co.th/author/grapelegal1/ https://farangmart.co.th/author/grapelegal1/
https://doc.aquilenet.fr/lq_NkVn3SmuAEJdMoLVW8w/ doc.aquilenet.fr
http://community.srhtech.net/user/rollpacket77 http://community.srhtech.net
http://historydb.date/index.php?title=lyhnemckenzie6436 historydb.date
https://support.mikrodev.com/index.php?qa=user&qa_1=meterstreet79 https://support.mikrodev.com/index.php?qa=user&qa_1=meterstreet79
https://viewcinema.ru/user/violagallon29/ https://viewcinema.ru/user/violagallon29
https://doc.aquilenet.fr/VWTAhuXtSXOn6fx8bxU1ew/ https://doc.aquilenet.fr/
https://huff-carey-2.federatedjournals.com/whats-the-ideal-post-dianabol-recovery-plan-discover-the-top-pct-options https://huff-carey-2.federatedjournals.com
http://qa.doujiju.com/index.php?qa=user&qa_1=windbass30 qa.doujiju.com
http://sorucevap.kodmerkezi.net/user/springhelen3 http://sorucevap.kodmerkezi.net/user/springhelen3
https://www.easyhits4u.com/profile.cgi?login=baillayer5&view_as=1 www.easyhits4u.com
https://www.pinterest.com/plowsampan54/ www.pinterest.com
https://www.anibookmark.com/user/vacuumsunday61.html www.anibookmark.com
https://pad.karuka.tech/kHrkXI3LQDqu1F7Gmv8bgQ/ https://pad.karuka.tech/kHrkXI3LQDqu1F7Gmv8bgQ/
http://woorichat.com/read-blog/121064 woorichat.com
https://b2b2cmarket.ru/user/profile/270774 https://b2b2cmarket.ru/
https://avtovoprosi.ru/user/schoollyre53 https://avtovoprosi.ru
https://www.netsdaily.com/users/nolan.krog www.netsdaily.com
https://list.ly/huff-mccall https://list.ly/huff-mccall
https://www.bitsdujour.com/profiles/GTv802 https://www.bitsdujour.com
https://apunto.it/user/profile/257556 apunto.it
https://squareblogs.net/healthtoilet02/is-solo-use-of-dianabol-safe-separating-fact-from-fiction https://squareblogs.net/
https://rentry.co/nuwy9bcm https://rentry.co/nuwy9bcm
https://eskisehiruroloji.com/sss/index.php?qa=user&qa_1=fuelyak27 eskisehiruroloji.com
https://molchanovonews.ru/user/weaponwasp61/ molchanovonews.ru
https://bom.so/qPXoW0 bom.so
https://moiafazenda.ru/user/rewardpaul1/ moiafazenda.ru
https://www.demilked.com/author/snailslope21/ https://www.demilked.com/author/snailslope21/
https://doc.adminforge.de/S0ZSHl1UT4OgUDF6VDcB_Q/ https://doc.adminforge.de/S0ZSHl1UT4OgUDF6VDcB_Q/
https://images.google.bi/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://images.google.bi/
https://medicallystaffing.com/employer/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ https://medicallystaffing.com/
https://www.copulousmedia.ie/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ copulousmedia.ie
https://forwardingjobs.com/companies/the-core-of-the-web/ https://forwardingjobs.com/
https://ftwjobfinder.com/companies/comparing-gh-peptides-sermorelin-vs-ipamorelin-cjc-1295-and-tesamorelin-for-research-use/ https://ftwjobfinder.com/
https://job.dialnumber.in/profile/elouisebold234 job.dialnumber.in
https://eliteyachtsclub.com/employer/ipamorelin-applications-advantages-pharmacodynamics-prescribed-doses-and-adverse-effects/ https://eliteyachtsclub.com
https://dev-members.writeappreviews.com/employer/synergistic-approach-pairing-sermorelin-with-ipamorelin-for-enhanced-results/ https://dev-members.writeappreviews.com/employer/synergistic-approach-pairing-sermorelin-with-ipamorelin-for-enhanced-results
https://talentfolder.com/employer/ipamorelin-vs-sermorelin-what-bodybuilders-need-to-know-about-benefits-doses-and-popular-blends/ talentfolder.com
https://www.munianiagencyltd.co.ke/employer/top-growth-hormone-peptide-picks-rankings-and-essential-insights/ munianiagencyltd.co.ke
https://profylelink.com/sdlcolette2820 profylelink.com
https://fmagency.co.uk/companies/which-growth-hormone-secretagogue-reigns-supreme-a-side-by-side-look-at-sermorelin-ipamorelin-and-tesamorelin/ fmagency.co.uk
https://flamingo.onl/fnekayleig flamingo.onl
https://7or.net/adrianamullin https://7or.net
https://flamingo.onl/fnekayleig https://flamingo.onl/fnekayleig
https://gelijkwerk.nl/employer/ipamorelin-vs-sermorelin-key-differences-explained/ gelijkwerk.nl
https://portalwe.net/employer/top-peptide-stacks-of-2025-the-definitive-guide/ portalwe.net
http://jobee.cubixdesigns.com/employer/tesamorelin-vs-sermorelin-vs-ipamorelin-a-comparative-review-of-the-research-findings/ jobee.cubixdesigns.com
https://career.abuissa.com/employer/sermorelin-and-ipamorelin-a-powerful-dual-peptide-regimen/ career.abuissa.com
https://forge.coreymclark.com/athenabilliot forge.coreymclark.com
https://gitea.boner.be/hzmlawrence105 gitea.boner.be
https://gitea.fcliu.net/kristinemault https://gitea.fcliu.net
https://gitea.jasonstolle.com/rosettaweigel gitea.jasonstolle.com
https://date.etogetherness.com/@tammarafawkner date.etogetherness.com
https://git.lolpro11.me/romanderham65 git.lolpro11.me
https://www.simpra.org:3000/rwjsylvester47 www.simpra.org
http://git.intelgice.com/bennettwri768 http://git.intelgice.com/
https://git.meohm.ddns.net/floriancrampto git.meohm.ddns.net
https://git.cydedu.com/jameudn7673427 git.cydedu.com
https://pilowtalks.com/@ginohiatt6315 pilowtalks.com
https://musiccosign.com/deanacornwell musiccosign.com
https://git.sayndone.ru/georgiachristo git.sayndone.ru
https://wiki.idealirc.org/jordanyca74117 wiki.idealirc.org
https://nas.zearon.com:2001/lorareardon76 nas.zearon.com
https://git.anacsoft.com/jorgpinnock977 git.anacsoft.com
https://cupido.prestigioapps.com/@gidgethitt439 cupido.prestigioapps.com
https://meetdatingpartners.com/@bridgetcreason meetdatingpartners.com
https://rentry.co/wert5s3n rentry.co
https://www.google.com.uy/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://www.google.com.uy/
https://viewcinema.ru/user/bottomfemale6/ viewcinema.ru
https://www.woorips.vic.edu.au/profile/mchughygjbooth16011/profile https://www.woorips.vic.edu.au
https://graph.org/KPV-Peptide-A-Quick-Reference-to-Its-Healing-Benefits-10-09 https://graph.org/KPV-Peptide-A-Quick-Reference-to-Its-Healing-Benefits-10-09
https://images.google.ad/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://images.google.ad/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects
https://maps.google.cv/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects maps.google.cv
https://prpack.ru/user/monthcrab4/ prpack.ru
https://www.orkhonschool.edu.mn/profile/husumiliblair65918/profile https://www.orkhonschool.edu.mn/profile/husumiliblair65918/profile
https://escatter11.fullerton.edu/nfs/show_user.php?userid=9311673 escatter11.fullerton.edu
https://molchanovonews.ru/user/stormred9/ molchanovonews.ru
https://prpack.ru/user/steplock7/ prpack.ru
https://livebookmark.stream/story.php?title=unveiling-kpv-its-powerful-anti-inflammatory-and-healing-properties livebookmark.stream
https://telegra.ph/BPC-157-Risks-and-Safeguards-Essential-Information-Prior-to-Use-10-09 telegra.ph
https://www.holycrossconvent.edu.na/profile/velezvuckiilerich35015/profile https://www.holycrossconvent.edu.na/profile/velezvuckiilerich35015/profile
https://viewcinema.ru/user/causeplate7/ viewcinema.ru
https://telegra.ph/KPV-Peptide-The-Ultimate-Anti-Inflammatory-Solution-for-Optimal-Outcomes-10-09 telegra.ph
https://reilly-bradshaw-2.mdwrite.net/cornell-study-finds-glp-1-medication-leads-to-significant-weight-reduction https://reilly-bradshaw-2.mdwrite.net/
https://gitea.dcqrr.top:83/carmeloblack79 https://gitea.dcqrr.top:83/carmeloblack79
https://gitea.zzspider.com/terriejlb60189 https://gitea.zzspider.com
https://repo.gusdya.net/veldawrenn456 repo.gusdya.net
http://gite.limi.ink/estherliversid gite.limi.ink
https://git-web.phomecoming.com/shoshanayoung7 https://git-web.phomecoming.com/
https://rightmeet.co.ke/@latoyastringfi rightmeet.co.ke
https://gitea.fcliu.net/kristinemault gitea.fcliu.net
https://gitea.marvinronk.com/haiholroyd5520 gitea.marvinronk.com
https://gt.clarifylife.net/susanne4739318 https://gt.clarifylife.net/susanne4739318
https://git.werkraum-karlsruhe.org/susangkn788221 git.werkraum-karlsruhe.org
http://dibodating.com/@janessamacon53 dibodating.com
http://git.jishutao.com/coopergunther3 git.jishutao.com
https://www.jokkey.com/jonivalladares www.jokkey.com
https://git.anibilag.ru/sterlingwsh68 git.anibilag.ru
https://volts.howto.co.ug/@solrolfe681411 volts.howto.co.ug
https://gitea.boner.be/hzmlawrence105 gitea.boner.be
https://mystdate.com/@celsa57y154594 mystdate.com
https://demo.indeksyazilim.com/bryanlienhop47 demo.indeksyazilim.com
http://www.rohitab.com/discuss/user/3169625-marianolaz/ http://www.rohitab.com
https://findmeacaregiver.com/employer/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ findmeacaregiver.com
https://futureblazr.com/employer/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ https://futureblazr.com/employer/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/
https://pixgen.site/normanstocks32 https://pixgen.site/
https://eliteyachtsclub.com/employer/ipamorelin-applications-advantages-pharmacodynamics-prescribed-doses-and-adverse-effects/ https://eliteyachtsclub.com/employer/ipamorelin-applications-advantages-pharmacodynamics-prescribed-doses-and-adverse-effects
https://qalmsecurity.nl/employer/ipamorelin-vs-sermorelin-key-differences-for-your-health-aesthetic-goals-in-orlando-fl-med-spa-weight-loss-peptide-therapy/ https://qalmsecurity.nl/employer/ipamorelin-vs-sermorelin-key-differences-for-your-health-aesthetic-goals-in-orlando-fl-med-spa-weight-loss-peptide-therapy/
https://robbarnettmedia.com/employer/sermorelin-journey-weekly-transformations-and-realistic-outcomes/ https://robbarnettmedia.com/employer/sermorelin-journey-weekly-transformations-and-realistic-outcomes/
https://gjejstaf.al/employer/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-peptide/ gjejstaf.al
https://hirenhigher.co.nz/companies/gh-peptides-showdown-sermorelin-vs-ipamorelin-cjc-1295-tesamorelin-for-research-use/ https://hirenhigher.co.nz
https://part-time.ie/companies/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ https://part-time.ie
https://clcs.site/mikayla6613740 clcs.site
https://eliteyachtsclub.com/employer/ipamorelin-applications-advantages-pharmacodynamics-prescribed-doses-and-adverse-effects/ eliteyachtsclub.com
https://clcs.site/mikayla6613740 clcs.site
http://kikijobs.com/employer/sermorelin-ipamorelin-combo-complete-review-and-essential-insights/ http://kikijobs.com
https://saek-kerkiras.edu.gr/employer/sermorelin-vs-ipamorelin-choosing-the-right-growth-hormone-secretagogue-for-you/ saek-kerkiras.edu.gr
https://nonprofitsjobs.com/employer/growth-hormone-secretagogues-compared-sermorelin-cjc-1295-ipamorelin-and-tesamorelin-for-peak-performance/ nonprofitsjobs.com
https://perseal.app/qfnabbey717289 https://perseal.app/
https://hitechjobs.me/companies/sermorelin-ipamorelin-blend-optimal-dosage-guide/ https://hitechjobs.me/
https://www.udrpsearch.com/user/treewire97 https://www.udrpsearch.com/
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/sandsail76/ http://--8sbec1b1ad1ae2f.бел
https://maps.google.cat/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.cat
https://www.google.com.om/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.com.om
https://play.ntop.tv/user/armydonald00/ play.ntop.tv
https://viewcinema.ru/user/cymbalsheep7/ viewcinema.ru
https://www.24propertyinspain.com/user/profile/1235383 https://www.24propertyinspain.com
https://rentry.co/vmnztfyd https://rentry.co/vmnztfyd
https://www.google.ci/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.ci
https://xn---6-jlc6c.xn--p1ai/user/bladepillow7/ https://-6-jlc6c.рф
http://www.annunciogratis.net/author/sistersyria8 www.annunciogratis.net
https://www.udrpsearch.com/user/cornpigeon05 www.udrpsearch.com
http://king-wifi.win//index.php?title=blairkjeldgaard9834 king-wifi.win
https://muhammad-ali.com.az/user/spoonsign6/ muhammad-ali.com.az
https://ondashboard.win/story.php?title=test-e-deca-and-dbol-cycles-australian-bodybuilding-fitness-forum-review https://ondashboard.win/story.php?title=test-e-deca-and-dbol-cycles-australian-bodybuilding-fitness-forum-review
https://www.google.co.zm/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.co.zm
http://mozillabd.science/index.php?title=mckeemack1748 http://mozillabd.science/index.php?title=mckeemack1748
https://wikimapia.org/external_link?url=https://www.valley.md/dianabol-before-and-after-results-you-can-expect wikimapia.org
http://09vodostok.ru/user/wishbacon64/ http://09vodostok.ru/
https://www.google.pn/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.pn/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://rentry.co/rwcz22re rentry.co
http://okprint.kz/user/conerandom56/ okprint.kz
http://tellmy.ru/user/mapjuice95/ tellmy.ru
https://www.udrpsearch.com/user/treeart34 www.udrpsearch.com
https://www.udrpsearch.com/user/rewardbattle5 https://www.udrpsearch.com
https://www.google.ki/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.ki
https://ondashboard.win/story.php?title=test-e-deca-and-dbol-cycles-australian-bodybuilding-fitness-forum-review https://ondashboard.win/story.php?title=test-e-deca-and-dbol-cycles-australian-bodybuilding-fitness-forum-review
http://hikvisiondb.webcam/index.php?title=williamsonstiles3596 http://hikvisiondb.webcam
https://justpin.date/story.php?title=dianabol-cycles-for-optimal-outcomes-titans%E2%80%99-go-to-steroid-choice https://justpin.date/
https://www.bitsdujour.com/profiles/GTv802 https://www.bitsdujour.com/
https://gratisafhalen.be/author/greyperch9/ https://gratisafhalen.be/
https://www.google.dm/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.dm/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://molchanovonews.ru/user/bathlayer20/ molchanovonews.ru
https://www.google.com.om/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.com.om
https://proxyrate.ru/user/securejuice71/ proxyrate.ru
https://a-taxi.com.ua/user/jumbodog69/ https://a-taxi.com.ua/user/jumbodog69/
https://www.instapaper.com/p/16989005 https://www.instapaper.com/p/16989005
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/harpskill13/ --7sbarohhk4a0dxb3c.рф
https://graph.org/Post-Dianabol-Recovery-Essential-Supplements-and-Strategies-10-08 https://graph.org/Post-Dianabol-Recovery-Essential-Supplements-and-Strategies-10-08
http://historydb.date/index.php?title=fogedmunn9018 historydb.date
https://a-taxi.com.ua/user/bargeperch5/ a-taxi.com.ua
https://muhammad-ali.com.az/user/talkadvice5/ muhammad-ali.com.az
http://king-wifi.win//index.php?title=reesmcgee6319 king-wifi.win
https://viewcinema.ru/user/cloudhumor4/ viewcinema.ru
https://urlscan.io/result/0199c3ac-f565-76c2-9706-ae9f41c2d5b9/ urlscan.io
https://firsturl.de/Y2Bay6m firsturl.de
https://urlscan.io/result/0199c3ab-223e-7769-a6cf-4ca938306b32/ urlscan.io
https://larson-day-2.federatedjournals.com/winstrol-101-the-ultimate-handbook-on-dosing-cycling-and-perks https://larson-day-2.federatedjournals.com
https://urlscan.io/result/0199c3b0-9e04-77fd-b6f6-1d1ff14dd0b5/ https://urlscan.io/
https://may22.ru/user/raingame68/ https://may22.ru/user/raingame68/
https://telegra.ph/Anadrol-vs-D-Bol-The-Definitive-Bulking-Showdown-10-08 telegra.ph
https://muhammad-ali.com.az/user/shamepigeon89/ muhammad-ali.com.az
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/harpskill13/ https://--7sbarohhk4a0dxb3c.рф/user/harpskill13/
https://xn---6-jlc6c.xn--p1ai/user/towerbottom79/ -6-jlc6c.рф
https://images.google.ms/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect images.google.ms
https://www.instapaper.com/p/16989057 https://www.instapaper.com
http://king-wifi.win//index.php?title=krebszimmermann8669 http://king-wifi.win//index.php?title=krebszimmermann8669
https://rentry.co/yxk3bhiz rentry.co
https://www.24propertyinspain.com/user/profile/1235298 24propertyinspain.com
https://rentry.co/nuwy9bcm rentry.co
https://firsturl.de/cq27IuM firsturl.de
http://lovewiki.faith/index.php?title=schofieldkamper5186 http://lovewiki.faith/index.php?title=schofieldkamper5186
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/grapearies5/ --7sbarohhk4a0dxb3c.рф
https://play.ntop.tv/user/armydonald00/ https://play.ntop.tv/
https://motionentrance.edu.np/profile/commaafrica5/ motionentrance.edu.np
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/grapearies5/ --7sbarohhk4a0dxb3c.рф
https://www.faax.org/author/congobill97/ faax.org
https://coolpot.stream/story.php?title=winstrol-in-bodybuilding-a-comprehensive-guide-to-dosage-benefits-risks-and-purchase-options https://coolpot.stream/story.php?title=winstrol-in-bodybuilding-a-comprehensive-guide-to-dosage-benefits-risks-and-purchase-options
https://urlscan.io/result/0199c3b0-9e04-77fd-b6f6-1d1ff14dd0b5/ urlscan.io
https://www.udrpsearch.com/user/chickshrimp57 https://www.udrpsearch.com/user/chickshrimp57
http://king-wifi.win//index.php?title=mitchellgriffith0755 king-wifi.win
https://greylegal6.werite.net/dianabol-transformations-revealed-stunning-before-and-after-photos-and-their https://greylegal6.werite.net/dianabol-transformations-revealed-stunning-before-and-after-photos-and-their
https://telegra.ph/The-D-BOL-and-Testosterone-Cycle-A-Comprehensive-Guide-10-08 telegra.ph
https://gpsites.win/story.php?title=dianabol-8-week-cycle-vs-4-week-dbol-cycle gpsites.win
http://historydb.date/index.php?title=johnsonhave2163 http://historydb.date/index.php?title=johnsonhave2163
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/grapearies5/ --7sbarohhk4a0dxb3c.рф
http://humanlove.stream//index.php?title=phamdue6356 http://humanlove.stream//index.php?title=phamdue6356
https://maps.google.fr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.fr/
http://humanlove.stream//index.php?title=vaughancole4833 humanlove.stream
https://locketart39.bravejournal.net/the-core-of-the-web locketart39.bravejournal.net
http://king-wifi.win//index.php?title=reesmcgee6319 king-wifi.win
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/sandsail76/ --8sbec1b1ad1ae2f.бел
https://bookmarkspot.win/story.php?title=deca-cycling-demystified-the-ultimate-handbook-for-beginners-and-pros https://bookmarkspot.win/story.php?title=deca-cycling-demystified-the-ultimate-handbook-for-beginners-and-pros
http://mozillabd.science/index.php?title=sunwise4287 mozillabd.science
https://brandmoshaver.com/user/windowcamp1/ https://brandmoshaver.com/
https://www.google.co.cr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.co.cr
https://skitterphoto.com/photographers/1601016/collins-rosa skitterphoto.com
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/coastshadow82/ https://--7sbarohhk4a0dxb3c.рф/user/coastshadow82/
http://09vodostok.ru/user/sandstar72/ 09vodostok.ru
http://hikvisiondb.webcam/index.php?title=hallnewman4241 http://hikvisiondb.webcam
https://muhammad-ali.com.az/user/talkadvice5/ muhammad-ali.com.az
http://www.annunciogratis.net/author/glovecurve1 http://www.annunciogratis.net
http://tellmy.ru/user/vacuumsunday61/ http://tellmy.ru/user/vacuumsunday61
http://humanlove.stream//index.php?title=walthergoldberg2266 humanlove.stream
https://rentry.co/io5xhu9a rentry.co
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623686 https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623686
https://proxyrate.ru/user/dancertea14/ https://proxyrate.ru/
https://quillhemp90.bravejournal.net/dianabol-cycling-your-complete-blueprint-to-a-massive-bulk quillhemp90.bravejournal.net
https://firsturl.de/ek321Nt https://firsturl.de/
http://king-wifi.win//index.php?title=mccabenorth5324 http://king-wifi.win/
https://muhammad-ali.com.az/user/talkadvice5/ muhammad-ali.com.az
http://www.annunciogratis.net/author/glovecurve1 annunciogratis.net
https://www.instapaper.com/p/16989459 www.instapaper.com
http://semdinlitesisat.eskisehirgocukduzeltme.com/user/creamclub1/ http://semdinlitesisat.eskisehirgocukduzeltme.com/
https://setiathome.berkeley.edu/show_user.php?userid=13247152 https://setiathome.berkeley.edu/
http://king-wifi.win//index.php?title=douglasladefoged4270 http://king-wifi.win
https://www.instapaper.com/p/16989399 www.instapaper.com
https://xn---6-jlc6c.xn--p1ai/user/sneezecream01/ -6-jlc6c.рф
https://firsturl.de/q64960e https://firsturl.de/
https://goodman-mcdougall.mdwrite.net/oxandrolone-anavar-uses-risks-dosing-and-key-facts https://goodman-mcdougall.mdwrite.net
https://rentry.co/7qxzed5q rentry.co
http://historydb.date/index.php?title=basswiley3792 historydb.date
https://bom.so/qPXoW0 bom.so
http://lovewiki.faith/index.php?title=mccainwallace1435 lovewiki.faith
https://www.google.com.co/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.com.co/
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/sandsail76/ --8sbec1b1ad1ae2f.бел
http://semdinlitesisat.eskisehirgocukduzeltme.com/user/shameidea51/ http://semdinlitesisat.eskisehirgocukduzeltme.com/
https://www.google.com.sb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.com.sb
http://hikvisiondb.webcam/index.php?title=mccallborch3932 hikvisiondb.webcam
https://stevenscent94.werite.net/cycling-dianabol-a-bodybuilders-guide https://stevenscent94.werite.net/cycling-dianabol-a-bodybuilders-guide
https://molchanovonews.ru/user/weaponwasp61/ molchanovonews.ru
https://autovin-info.com/user/quailbook81/ https://autovin-info.com/user/quailbook81
https://play.ntop.tv/user/detailfox44/ play.ntop.tv
https://molchanovonews.ru/user/bathlayer20/ molchanovonews.ru
https://oliver-kring.federatedjournals.com/the-core-pulse-of-the-web https://oliver-kring.federatedjournals.com/the-core-pulse-of-the-web
https://saveyoursite.date/story.php?title=testosterone-key-role-in-every-steroid-cycle-trt-insights-potential-risks saveyoursite.date
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623494 https://gaiaathome.eu
https://skitterphoto.com/photographers/1600670/chen-duelund skitterphoto.com
https://maps.google.com.lb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.com.lb
http://lovewiki.faith/index.php?title=lowryhawkins6534 http://lovewiki.faith
https://motionentrance.edu.np/profile/rolllunch79/ https://motionentrance.edu.np
https://www.google.at/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.at/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://autovin-info.com/user/sexchalk29/ autovin-info.com
https://urlscan.io/result/0199c39f-4c83-76ad-b086-afb9e611e194/ urlscan.io
http://king-wifi.win//index.php?title=ballmarsh5275 king-wifi.win
https://urlscan.io/result/0199c3a2-4851-74ee-9be5-5c24a34d4544/ https://urlscan.io
https://maps.google.com.tr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.com.tr
https://ryberg-drake-2.mdwrite.net/all-about-anavar-cycles-and-stackings-the-ultimate-guide ryberg-drake-2.mdwrite.net
https://www.instapaper.com/p/16989459 https://www.instapaper.com/p/16989459
https://may22.ru/user/parcelfrance0/ https://may22.ru/
https://xn---6-jlc6c.xn--p1ai/user/bladepillow7/ -6-jlc6c.рф
https://www.24propertyinspain.com/user/profile/1235365 https://www.24propertyinspain.com/user/profile/1235365
https://molchanovonews.ru/user/weaponwasp61/ molchanovonews.ru
https://maps.google.nr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.nr
https://www.24propertyinspain.com/user/profile/1235298 www.24propertyinspain.com
https://mensvault.men/story.php?title=dianabol-cycle-mastering-5-mg-10-mg-and-50-mg-%E2%80%93-training-your-mind-to-sculpt-your-body mensvault.men
https://www.instapaper.com/p/16989116 instapaper.com
https://www.instapaper.com/p/16989459 instapaper.com
https://www.bitsdujour.com/profiles/uW77wa https://www.bitsdujour.com/
https://rentry.co/vmnztfyd rentry.co
https://muhammad-ali.com.az/user/turkeyship06/ https://muhammad-ali.com.az/
http://historydb.date/index.php?title=johnsonhave2163 historydb.date
https://images.google.com.gt/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://images.google.com.gt/
https://www.google.pl/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.pl/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://viewcinema.ru/user/tripfox00/ https://viewcinema.ru/
https://muhammad-ali.com.az/user/turkeyship06/ muhammad-ali.com.az
https://images.google.be/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect images.google.be
https://bookmarkingworld.review/story.php?title=-mastering-trenbolone-the-ultimate-guide-to-cycling-and-stacking https://bookmarkingworld.review/story.php?title=-mastering-trenbolone-the-ultimate-guide-to-cycling-and-stacking
https://aryba.kg/user/riskbasin51/ https://aryba.kg/user/riskbasin51/
https://shameisrael03.werite.net/five-prime-dianabol-stack-recipes-to-maximize-muscle-gains https://shameisrael03.werite.net/five-prime-dianabol-stack-recipes-to-maximize-muscle-gains
https://aryba.kg/user/wormlove65/ https://aryba.kg/
http://09vodostok.ru/user/lovebutane51/ 09vodostok.ru
https://buketik39.ru/user/treeteam70/ https://buketik39.ru/
https://www.google.co.mz/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.co.mz
https://maps.google.com.pr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.com.pr
https://telegra.ph/Dianabol-Dosing-Guide-Optimal-Amounts-for-Men-Bodybuilders-and-Steroid-Cycles-10-08 https://telegra.ph/
https://maps.google.com.tr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.com.tr/
http://09vodostok.ru/user/pricepyjama47/ http://09vodostok.ru/user/pricepyjama47
http://09vodostok.ru/user/weaponfaucet76/ 09vodostok.ru
http://lovewiki.faith/index.php?title=schofieldkamper5186 http://lovewiki.faith/index.php?title=schofieldkamper5186
https://www.google.ki/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.ki
http://pattern-wiki.win/index.php?title=hartmanndoyle8262 pattern-wiki.win
https://molchanovonews.ru/user/woolsmoke26/ molchanovonews.ru
http://hikvisiondb.webcam/index.php?title=crossboyette8703 http://hikvisiondb.webcam
https://www.google.com.sb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.com.sb
https://telegra.ph/Anadrol-vs-D-Bol-The-Definitive-Bulking-Showdown-10-08 https://telegra.ph
http://okprint.kz/user/brickkayak21/ okprint.kz
http://tellmy.ru/user/walkscent99/ tellmy.ru
http://pattern-wiki.win/index.php?title=ballelindegaard7022 pattern-wiki.win
http://pattern-wiki.win/index.php?title=johanssonbyrne6438 pattern-wiki.win
https://www.faax.org/author/shortsenemy14/ www.faax.org
https://coolpot.stream/story.php?title=winstrol-in-bodybuilding-a-comprehensive-guide-to-dosage-benefits-risks-and-purchase-options https://coolpot.stream/story.php?title=winstrol-in-bodybuilding-a-comprehensive-guide-to-dosage-benefits-risks-and-purchase-options
https://muhammad-ali.com.az/user/windowbacon51/ https://muhammad-ali.com.az/
https://www.instapaper.com/p/16989005 www.instapaper.com
https://bookmarks4.men/story.php?title=dianabol-101-mastering-simple-effective-cycles-from-novice-to-pro%E2%80%94science-budget-and-zero-bloating-guide https://bookmarks4.men/story.php?title=dianabol-101-mastering-simple-effective-cycles-from-novice-to-pro—science-budget-and-zero-bloating-guide
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623455 https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623455
https://www.google.com.gi/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.com.gi
http://mozillabd.science/index.php?title=bentzenjuhl0944 http://mozillabd.science
https://proxyrate.ru/user/cameraheaven72/ proxyrate.ru
http://historydb.date/index.php?title=bondsimonsen3568 historydb.date
https://setiathome.berkeley.edu/show_user.php?userid=13246831 setiathome.berkeley.edu
https://rentry.co/7boxep88 https://rentry.co
https://www.argfx1.com/user/emeryship39/ www.argfx1.com
http://mozillabd.science/index.php?title=hestersutherland5816 http://mozillabd.science/index.php?title=hestersutherland5816
https://www.google.pt/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.pt
https://graph.org/Top-3-Starter-Steroids-and-3-That-Should-Be-Skipped-for-New-Users-10-08 https://graph.org/
http://okprint.kz/user/mariacamp6/ http://okprint.kz/
https://www.argfx1.com/user/emeryship39/ www.argfx1.com
http://pattern-wiki.win/index.php?title=johanssonbyrne6438 pattern-wiki.win
https://www.24propertyinspain.com/user/profile/1235315 www.24propertyinspain.com
http://semdinlitesisat.eskisehirgocukduzeltme.com/user/ganderbrace52/ semdinlitesisat.eskisehirgocukduzeltme.com
https://maps.google.cat/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.cat
https://www.udrpsearch.com/user/cornpigeon05 https://www.udrpsearch.com/
http://pattern-wiki.win/index.php?title=ortegakennedy3189 http://pattern-wiki.win/
http://lovewiki.faith/index.php?title=sheridantorp3513 lovewiki.faith
https://images.google.com.ly/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect images.google.com.ly
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/levelbeast34/ --8sbec1b1ad1ae2f.бел
https://www.instapaper.com/p/16988934 www.instapaper.com
https://bom.so/qPXoW0 bom.so
https://www.google.mn/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.mn
https://justbookmark.win/story.php?title=alternative-titles https://justbookmark.win/story.php?title=alternative-titles
https://setiathome.berkeley.edu/show_user.php?userid=13247152 https://setiathome.berkeley.edu/show_user.php?userid=13247152
http://www.annunciogratis.net/author/cementsnow76 http://www.annunciogratis.net
http://pattern-wiki.win/index.php?title=johanssonbyrne6438 http://pattern-wiki.win
https://www.instapaper.com/p/16989261 www.instapaper.com
https://may22.ru/user/windowstorm9/ https://may22.ru/user/windowstorm9/
https://proxyrate.ru/user/sandcone2/ proxyrate.ru
https://justpin.date/story.php?title=dianabol-cycles-for-optimal-outcomes-titans%E2%80%99-go-to-steroid-choice justpin.date
https://firsturl.de/1l4y6ai firsturl.de
https://bookmarkfeeds.stream/story.php?title=anavar-cycling-demystified-a-complete-beginner%E2%80%99s-and-expert%E2%80%99s-handbook bookmarkfeeds.stream
http://historydb.date/index.php?title=cunninghammonahan7428 historydb.date
https://prpack.ru/user/kiteshrimp20/ prpack.ru
https://maps.google.gg/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.gg/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://images.google.com.sv/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect images.google.com.sv
https://graph.org/Mastering-the-Test-and-Masteron-Cycle-A-Comprehensive-Guide-10-08 https://graph.org/Mastering-the-Test-and-Masteron-Cycle-A-Comprehensive-Guide-10-08
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/wormhell21/ --7sbarohhk4a0dxb3c.рф
https://lejournaldedubai.com/user/garliclaw4/ https://lejournaldedubai.com/
http://stroyrem-master.ru/user/catsuphome3/ http://stroyrem-master.ru
https://www.google.dm/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.dm
https://www.google.com.co/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.com.co
https://huff-carey-2.federatedjournals.com/whats-the-ideal-post-dianabol-recovery-plan-discover-the-top-pct-options huff-carey-2.federatedjournals.com
https://www.google.co.zm/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.co.zm
https://prpack.ru/user/jumbomile2/ prpack.ru
https://urlscan.io/result/0199c3b0-9e04-77fd-b6f6-1d1ff14dd0b5/ https://urlscan.io/result/0199c3b0-9e04-77fd-b6f6-1d1ff14dd0b5
http://historydb.date/index.php?title=basswiley3792 historydb.date
https://skitterphoto.com/photographers/1600670/chen-duelund https://skitterphoto.com
https://bookmarkstore.download/story.php?title=dianabol-and-testosterone-cycle-overview-dosages-and-expected-outcomes bookmarkstore.download
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623547 https://gaiaathome.eu/
https://urlscan.io/result/0199c397-ec2d-73c9-8741-8e19a7b6ecf9/ urlscan.io
https://play.ntop.tv/user/detailfox44/ play.ntop.tv
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/levelbeast34/ http://--8sbec1b1ad1ae2f.бел
http://lovewiki.faith/index.php?title=albrektsenlambert5322 lovewiki.faith
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/harpskill13/ --7sbarohhk4a0dxb3c.рф
https://molchanovonews.ru/user/botanybutane45/ molchanovonews.ru
https://maps.google.com.qa/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.com.qa
http://humanlove.stream//index.php?title=donnellymortensen2937 humanlove.stream
http://king-wifi.win//index.php?title=krebszimmermann8669 http://king-wifi.win/
http://pattern-wiki.win/index.php?title=haystillman0164 http://pattern-wiki.win/index.php?title=haystillman0164
https://lejournaldedubai.com/user/briangrip77/ lejournaldedubai.com
https://www.bitsdujour.com/profiles/mUYdw2 https://www.bitsdujour.com/profiles/mUYdw2
https://www.faax.org/author/matchhour0/ https://www.faax.org
https://www.google.fm/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.fm
http://humanlove.stream//index.php?title=holmepark9237 humanlove.stream
https://lejournaldedubai.com/user/versepaul51/ https://lejournaldedubai.com/user/versepaul51
https://freebookmarkstore.win/story.php?title=post-dianabol-recovery-discover-the-optimal-pct-protocols https://freebookmarkstore.win/
https://muhammad-ali.com.az/user/shrimpdigger5/ muhammad-ali.com.az
https://autovin-info.com/user/knightpaul01/ https://autovin-info.com
https://stringsign4.bravejournal.net/whats-the-ideal-post-dianabol-recovery-plan stringsign4.bravejournal.net
http://mozillabd.science/index.php?title=cashnorwood9674 http://mozillabd.science/
https://wikimapia.org/external_link?url=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://wikimapia.org/external_link?url=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://images.google.com.my/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://images.google.com.my/
https://signclub8.werite.net/metandienone-dianabol-a-comprehensive-overview https://signclub8.werite.net/metandienone-dianabol-a-comprehensive-overview
https://images.google.cf/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://images.google.cf/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/botanyleaf21/ --7sbarohhk4a0dxb3c.рф
http://okprint.kz/user/clothwrench82/ okprint.kz
https://www.udrpsearch.com/user/cymbalice6 www.udrpsearch.com
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623686 gaiaathome.eu
http://09vodostok.ru/user/pricepyjama47/ http://09vodostok.ru
https://graph.org/Top-3-Starter-Steroids-and-3-That-Should-Be-Skipped-for-New-Users-10-08 graph.org
https://madden-lindhardt-2.mdwrite.net/when-should-you-take-dianabol-before-or-after-your-workout madden-lindhardt-2.mdwrite.net
https://school-of-safety-russia.ru/user/wirepants95/ https://school-of-safety-russia.ru/
https://maps.google.mw/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.mw
https://setiathome.berkeley.edu/show_user.php?userid=13247112 setiathome.berkeley.edu
https://gratisafhalen.be/author/greyperch9/ https://gratisafhalen.be/author/greyperch9
https://xn---6-jlc6c.xn--p1ai/user/skirtheron43/ -6-jlc6c.рф
http://humanlove.stream//index.php?title=langhaas4583 humanlove.stream
http://09vodostok.ru/user/limitvacuum25/ 09vodostok.ru
https://setiathome.berkeley.edu/show_user.php?userid=13246831 setiathome.berkeley.edu
https://walletwedge24.werite.net/optimizing-performance-with-a-structured-dianabol-regimen https://walletwedge24.werite.net/
https://maps.google.cat/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.cat
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/harpskill13/ --7sbarohhk4a0dxb3c.рф
https://firsturl.de/I2Qzvms firsturl.de
https://urlscan.io/result/0199c3a6-b130-710e-8dea-2047d2308c94/ https://urlscan.io/result/0199c3a6-b130-710e-8dea-2047d2308c94
http://okprint.kz/user/briannerve53/ http://okprint.kz/
https://huff-carey-2.federatedjournals.com/whats-the-ideal-post-dianabol-recovery-plan-discover-the-top-pct-options https://huff-carey-2.federatedjournals.com
https://viewcinema.ru/user/jasonlyre37/ viewcinema.ru
https://may22.ru/user/winggallon97/ may22.ru
http://historydb.date/index.php?title=boothwilkins2377 http://historydb.date
https://aryba.kg/user/cinemanerve59/ aryba.kg
https://urlscan.io/result/0199c39b-4fbf-776d-842d-3a59449ce55f/ urlscan.io
https://maps.google.hr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.hr
https://oliver-kring.federatedjournals.com/the-core-pulse-of-the-web https://oliver-kring.federatedjournals.com/the-core-pulse-of-the-web
http://mozillabd.science/index.php?title=hydenoonan3579 mozillabd.science
https://www.google.bs/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.bs/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://maps.google.com.sa/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.com.sa
https://www.google.sc/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.sc
https://bookmarkspot.win/story.php?title=deca-cycling-demystified-the-ultimate-handbook-for-beginners-and-pros bookmarkspot.win
http://lovewiki.faith/index.php?title=hviidkearns8033 http://lovewiki.faith
https://skitterphoto.com/photographers/1600835/hanley-bauer https://skitterphoto.com/photographers/1600835/hanley-bauer
http://semdinlitesisat.eskisehirgocukduzeltme.com/user/smokecamera47/ semdinlitesisat.eskisehirgocukduzeltme.com
https://livebookmark.stream/story.php?title=dianabol-testosterone-cycle-dosages-outcomes-and-expert-guidance livebookmark.stream
https://proxyrate.ru/user/dancertea14/ https://proxyrate.ru/user/dancertea14
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/wormhell21/ https://--7sbarohhk4a0dxb3c.рф
https://www.google.mn/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.mn/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
http://hikvisiondb.webcam/index.php?title=bernardbegum2263 hikvisiondb.webcam
https://setiathome.berkeley.edu/show_user.php?userid=13246870 setiathome.berkeley.edu
https://setiathome.berkeley.edu/show_user.php?userid=13246831 https://setiathome.berkeley.edu/show_user.php?userid=13246831
https://xn---6-jlc6c.xn--p1ai/user/towerbottom79/ -6-jlc6c.рф
https://xn---6-jlc6c.xn--p1ai/user/armyvan96/ https://-6-jlc6c.рф
https://muhammad-ali.com.az/user/shamepigeon89/ https://muhammad-ali.com.az/user/shamepigeon89/
http://09vodostok.ru/user/flowerpaul8/ http://09vodostok.ru
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623547 gaiaathome.eu
https://lejournaldedubai.com/user/garliclaw4/ https://lejournaldedubai.com/
https://xn---6-jlc6c.xn--p1ai/user/skirtheron43/ https://-6-jlc6c.рф/user/skirtheron43/
https://www.google.com.om/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.com.om/
https://www.google.co.cr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.co.cr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://maps.google.com.lb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.com.lb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
http://stroyrem-master.ru/user/riddleweek65/ stroyrem-master.ru
http://karayaz.ru/user/lankey2/ http://karayaz.ru
https://setiathome.berkeley.edu/show_user.php?userid=13246967 setiathome.berkeley.edu
https://muhammad-ali.com.az/user/spoonsign6/ https://muhammad-ali.com.az
https://graph.org/Dianabol-Use-Guide-Common-Questions--Safe-Use-Strategies-10-08 graph.org
https://maps.google.gg/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.gg
https://buketik39.ru/user/germanmile1/ buketik39.ru
http://pattern-wiki.win/index.php?title=johanssonbyrne6438 http://pattern-wiki.win/index.php?title=johanssonbyrne6438
https://livebookmark.stream/story.php?title=dianabol-testosterone-cycle-dosages-outcomes-and-expert-guidance https://livebookmark.stream/
https://prpack.ru/user/briancause14/ https://prpack.ru/
http://mozillabd.science/index.php?title=bentzenjuhl0944 http://mozillabd.science/index.php?title=bentzenjuhl0944
http://lovewiki.faith/index.php?title=mccainwallace1435 lovewiki.faith
https://images.google.com.sv/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect images.google.com.sv
https://www.24propertyinspain.com/user/profile/1235395 www.24propertyinspain.com
https://urlscan.io/result/0199c3b0-9e04-77fd-b6f6-1d1ff14dd0b5/ urlscan.io
https://peatix.com/user/27956295 https://peatix.com/
http://okprint.kz/user/mariacamp6/ http://okprint.kz/
https://www.google.co.ao/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.co.ao
https://brandmoshaver.com/user/windowcamp1/ https://brandmoshaver.com/
https://urlscan.io/result/0199c3ac-f565-76c2-9706-ae9f41c2d5b9/ https://urlscan.io/result/0199c3ac-f565-76c2-9706-ae9f41c2d5b9/
https://graph.org/Dianabol-DBol-Steroid-Regimen-for-Optimal-Muscle-Bulk-and-Mass-Gain-10-08 graph.org
https://saveyoursite.date/story.php?title=testosterone-key-role-in-every-steroid-cycle-trt-insights-potential-risks saveyoursite.date
http://humanlove.stream//index.php?title=martinezovesen5007 http://humanlove.stream//index.php?title=martinezovesen5007
https://www.google.com.om/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.com.om
https://skitterphoto.com/photographers/1600499/guthrie-farmer skitterphoto.com
https://firsturl.de/9OMp34E firsturl.de
https://www.faax.org/author/shortsenemy14/ faax.org
https://www.google.ps/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.ps/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://skitterphoto.com/photographers/1601552/jochumsen-jokumsen skitterphoto.com
https://www.bitsdujour.com/profiles/R0RwRp https://www.bitsdujour.com/profiles/R0RwRp
http://humanlove.stream//index.php?title=holmepark9237 humanlove.stream
https://gratisafhalen.be/author/massskin87/ https://gratisafhalen.be/
http://king-wifi.win//index.php?title=mccabenorth5324 king-wifi.win
https://irisadvice8.bravejournal.net/dianabol-cycle-frequently-asked-questions-and-harm-reduction-guidelines irisadvice8.bravejournal.net
https://www.youtube.com/redirect?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.youtube.com
https://buketik39.ru/user/boltblade94/ buketik39.ru
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/voicecone0/ --7sbarohhk4a0dxb3c.рф
https://buketik39.ru/user/bailgrey82/ buketik39.ru
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/coastshadow82/ --7sbarohhk4a0dxb3c.рф
https://www.google.com.uy/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.com.uy
https://urlscan.io/result/0199c3a4-2d8b-775e-88e2-3e064960f9dd/ https://urlscan.io/result/0199c3a4-2d8b-775e-88e2-3e064960f9dd/
http://karayaz.ru/user/lankey2/ karayaz.ru
https://maps.google.cv/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.cv/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://xn---6-jlc6c.xn--p1ai/user/sneezecream01/ -6-jlc6c.рф
http://karayaz.ru/user/panvault88/ karayaz.ru
https://skitterphoto.com/photographers/1602023/lamb-palmer https://skitterphoto.com/photographers/1602023/lamb-palmer
https://rentry.co/ddyn2xkr https://rentry.co/ddyn2xkr
https://www.instapaper.com/p/16989116 https://www.instapaper.com/
http://hikvisiondb.webcam/index.php?title=doganbowling9600 http://hikvisiondb.webcam/index.php?title=doganbowling9600
http://historydb.date/index.php?title=fogedmunn9018 http://historydb.date/index.php?title=fogedmunn9018
https://viewcinema.ru/user/cymbalsheep7/ https://viewcinema.ru
https://firsturl.de/6rQlKvz firsturl.de
https://urlscan.io/result/0199c397-ec2d-73c9-8741-8e19a7b6ecf9/ https://urlscan.io/
https://maps.google.gg/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.gg/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://urlscan.io/result/0199c3ab-223e-7769-a6cf-4ca938306b32/ urlscan.io
https://lejournaldedubai.com/user/circleprint56/ lejournaldedubai.com
https://autovin-info.com/user/sexchalk29/ https://autovin-info.com/user/sexchalk29/
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/sandsail76/ --8sbec1b1ad1ae2f.бел
http://okprint.kz/user/conerandom56/ okprint.kz
https://images.google.is/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect images.google.is
https://buketik39.ru/user/prunerroom1/ buketik39.ru
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/harpskill13/ --7sbarohhk4a0dxb3c.рф
http://www.annunciogratis.net/author/meatbasin31 www.annunciogratis.net
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/grapearies5/ --7sbarohhk4a0dxb3c.рф
https://www.argfx1.com/user/emeryship39/ www.argfx1.com
https://telegra.ph/Dianabol-101-Beginners-Cycle-Guide--Results-Dosage-Charts--Timing-10-08 telegra.ph
https://xn---6-jlc6c.xn--p1ai/user/skirtheron43/ https://-6-jlc6c.рф/user/skirtheron43
https://muhammad-ali.com.az/user/windowbacon51/ muhammad-ali.com.az
https://www.udrpsearch.com/user/cymbalice6 www.udrpsearch.com
http://pattern-wiki.win/index.php?title=johanssonbyrne6438 http://pattern-wiki.win
https://gpsites.stream/story.php?title=anabolic-fundamentals-for-newbies-your-complete-starter-guide https://gpsites.stream/story.php?title=anabolic-fundamentals-for-newbies-your-complete-starter-guide
https://www.google.sc/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.sc
https://huff-carey-2.federatedjournals.com/whats-the-ideal-post-dianabol-recovery-plan-discover-the-top-pct-options https://huff-carey-2.federatedjournals.com
https://setiathome.berkeley.edu/show_user.php?userid=13247188 https://setiathome.berkeley.edu/
https://graph.org/Top-3-Starter-Steroids-and-3-That-Should-Be-Skipped-for-New-Users-10-08 graph.org
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623630 https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623630
https://skitterphoto.com/photographers/1600670/chen-duelund https://skitterphoto.com
https://proxyrate.ru/user/securejuice71/ proxyrate.ru
https://walletwedge24.werite.net/optimizing-performance-with-a-structured-dianabol-regimen walletwedge24.werite.net
https://www.google.com.uy/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.com.uy
https://maps.google.com.tr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.com.tr/
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623630 gaiaathome.eu
http://lovewiki.faith/index.php?title=levinbyrd3521 lovewiki.faith
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623630 https://gaiaathome.eu
https://firsturl.de/q64960e https://firsturl.de
https://urlscan.io/result/0199c3ab-223e-7769-a6cf-4ca938306b32/ https://urlscan.io/
https://www.udrpsearch.com/user/cymbalice6 www.udrpsearch.com
http://lovewiki.faith/index.php?title=mckeeharrison7586 http://lovewiki.faith
http://pattern-wiki.win/index.php?title=munksgaardbech5268 pattern-wiki.win
https://prpack.ru/user/subwayenemy31/ https://prpack.ru
https://www.instapaper.com/p/16989005 www.instapaper.com
https://may22.ru/user/trainstone71/ may22.ru
https://thorhauge-byskov-2.federatedjournals.com/beginners-guide-to-d-bol-cycle-length-dosages-effects-and-expected-gains https://thorhauge-byskov-2.federatedjournals.com/beginners-guide-to-d-bol-cycle-length-dosages-effects-and-expected-gains
https://autovin-info.com/user/riceglue3/ https://autovin-info.com
https://bookmarks4.men/story.php?title=dianabol-101-mastering-simple-effective-cycles-from-novice-to-pro%E2%80%94science-budget-and-zero-bloating-guide https://bookmarks4.men/
https://www.google.pn/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.pn
http://semdinlitesisat.eskisehirgocukduzeltme.com/user/coneschool64/ http://semdinlitesisat.eskisehirgocukduzeltme.com
https://www.google.co.uz/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.co.uz/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://images.google.ad/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect images.google.ad
https://www.google.com.ai/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.com.ai/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://marshallcountyalabamademocraticparty.com/author/bearsmash6/ https://marshallcountyalabamademocraticparty.com/author/bearsmash6/
https://buketik39.ru/user/germanmile1/ https://buketik39.ru/
http://humanlove.stream//index.php?title=langhaas4583 http://humanlove.stream//index.php?title=langhaas4583
https://maps.google.com.lb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.com.lb
https://telegra.ph/Dianabol-101-Beginners-Cycle-Guide--Results-Dosage-Charts--Timing-10-08 https://telegra.ph/
http://king-wifi.win//index.php?title=blairkjeldgaard9834 king-wifi.win
https://octaveyoke55.werite.net/post-cycle-care-the-ultimate-safe-pct-handbook octaveyoke55.werite.net
http://pattern-wiki.win/index.php?title=munksgaardbech5268 http://pattern-wiki.win
https://www.google.com.ag/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.com.ag
https://www.udrpsearch.com/user/bailknife05 https://www.udrpsearch.com
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623714 gaiaathome.eu
https://www.google.ps/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.ps
https://prpack.ru/user/subwayenemy31/ prpack.ru
https://www.bitsdujour.com/profiles/mLyYkA https://www.bitsdujour.com/profiles/mLyYkA
https://peatix.com/user/27955937 https://peatix.com/user/27955937
https://graph.org/Dianabol-DBol-Steroid-Regimen-for-Optimal-Muscle-Bulk-and-Mass-Gain-10-08 https://graph.org/Dianabol-DBol-Steroid-Regimen-for-Optimal-Muscle-Bulk-and-Mass-Gain-10-08
http://mozillabd.science/index.php?title=sunwise4287 mozillabd.science
https://richards-brun.mdwrite.net/proviron-usage-guide-optimal-dose-and-timing-schedule-for-effective-results https://richards-brun.mdwrite.net/proviron-usage-guide-optimal-dose-and-timing-schedule-for-effective-results
https://emerycheck48.werite.net/shia-labeouf-reveals-steroid-use-for-25-kg-weight-gain-why-his-candor-matters https://emerycheck48.werite.net/
https://urlscan.io/result/0199c3ab-223e-7769-a6cf-4ca938306b32/ https://urlscan.io
https://motionentrance.edu.np/profile/germangeorge1/ motionentrance.edu.np
https://setiathome.berkeley.edu/show_user.php?userid=13247010 setiathome.berkeley.edu
https://lejournaldedubai.com/user/violabass22/ lejournaldedubai.com
https://petsugar14.bravejournal.net/the-core-of-the-web https://petsugar14.bravejournal.net/
https://viewcinema.ru/user/jasonlyre37/ viewcinema.ru
https://rentry.co/nuwy9bcm https://rentry.co/nuwy9bcm
https://buketik39.ru/user/prunerroom1/ buketik39.ru
https://www.google.co.mz/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.co.mz
http://humanlove.stream//index.php?title=donnellymortensen2937 http://humanlove.stream
https://may22.ru/user/locketdimple03/ may22.ru
http://stroyrem-master.ru/user/sushitray8/ http://stroyrem-master.ru
https://maps.google.com.lb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.com.lb/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
http://lovewiki.faith/index.php?title=albrektsenlambert5322 http://lovewiki.faith
http://lovewiki.faith/index.php?title=mccainwallace1435 lovewiki.faith
https://setiathome.berkeley.edu/show_user.php?userid=13247051 setiathome.berkeley.edu
https://xn---6-jlc6c.xn--p1ai/user/armyvan96/ https://-6-jlc6c.рф/user/armyvan96/
https://buketik39.ru/user/crackbill06/ buketik39.ru
https://aryba.kg/user/weaponbeam4/ https://aryba.kg
https://xn---6-jlc6c.xn--p1ai/user/sleepbutane10/ -6-jlc6c.рф
https://gratisafhalen.be/author/crackviola23/ gratisafhalen.be
https://www.24propertyinspain.com/user/profile/1235365 www.24propertyinspain.com
https://www.24propertyinspain.com/user/profile/1235395 https://www.24propertyinspain.com/
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/sneezepond00/ --8sbec1b1ad1ae2f.бел
https://setiathome.berkeley.edu/show_user.php?userid=13247188 setiathome.berkeley.edu
https://firsturl.de/q64960e firsturl.de
https://gratisafhalen.be/author/wingsugar14/ gratisafhalen.be
https://www.bitsdujour.com/profiles/mUYdw2 https://www.bitsdujour.com/profiles/mUYdw2
https://bookmark4you.win/story.php?title=boldenone-equipoise-%E2%80%93-an-in-depth-overview bookmark4you.win
https://bookmarking.stream/story.php?title=deca-dbol-sustanon-250-a-comprehensive-trt-cycle-overview https://bookmarking.stream/
https://graph.org/Dianabol-Cycling-Your-Comprehensive-Roadmap-to-a-Natural-Bulk-10-08 https://graph.org
https://setiathome.berkeley.edu/show_user.php?userid=13246831 setiathome.berkeley.edu
https://motionentrance.edu.np/profile/noisebook84/ https://motionentrance.edu.np/profile/noisebook84
https://setiathome.berkeley.edu/show_user.php?userid=13246831 https://setiathome.berkeley.edu/
https://play.ntop.tv/user/riddleotter45/ https://play.ntop.tv/user/riddleotter45/
https://rentry.co/7qxzed5q https://rentry.co
http://okprint.kz/user/lipsyria0/ okprint.kz
http://okprint.kz/user/brickkayak21/ http://okprint.kz/
https://saveyoursite.date/story.php?title=testosterone-key-role-in-every-steroid-cycle-trt-insights-potential-risks https://saveyoursite.date/
https://images.google.be/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://images.google.be/
https://setiathome.berkeley.edu/show_user.php?userid=13247010 setiathome.berkeley.edu
https://buketik39.ru/user/treeteam70/ buketik39.ru
https://freebookmarkstore.win/story.php?title=post-dianabol-recovery-discover-the-optimal-pct-protocols https://freebookmarkstore.win/
https://bom.so/qPXoW0 bom.so
https://linkagogo.trade/story.php?title=-%E2%80%9Cdianabol-a-complete-cycle-guide-for-bodybuilders%E2%80%9D linkagogo.trade
https://www.instapaper.com/p/16989116 www.instapaper.com
https://a-taxi.com.ua/user/bucketgrass42/ a-taxi.com.ua
https://images.google.co.il/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://images.google.co.il
https://www.bitsdujour.com/profiles/mLyYkA https://www.bitsdujour.com/profiles/mLyYkA
http://www.annunciogratis.net/author/yogurtpull8 www.annunciogratis.net
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623686 https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623686
http://hikvisiondb.webcam/index.php?title=hviidcarlsen1868 hikvisiondb.webcam
http://hikvisiondb.webcam/index.php?title=williamsonstiles3596 hikvisiondb.webcam
http://hikvisiondb.webcam/index.php?title=williamsonstiles3596 hikvisiondb.webcam
https://www.google.com.pe/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect www.google.com.pe
http://hikvisiondb.webcam/index.php?title=crossboyette8703 hikvisiondb.webcam
https://tunepond09.bravejournal.net/pct-basics-a-practical-guide-to-nolvadex-clomid-and-hcg-after-cycling https://tunepond09.bravejournal.net/pct-basics-a-practical-guide-to-nolvadex-clomid-and-hcg-after-cycling
https://school-of-safety-russia.ru/user/bucketlayer61/ https://school-of-safety-russia.ru
http://mozillabd.science/index.php?title=bentzenjuhl0944 http://mozillabd.science
http://lovewiki.faith/index.php?title=levinbyrd3521 lovewiki.faith
https://autovin-info.com/user/sexchalk29/ autovin-info.com
https://motionentrance.edu.np/profile/noisebook84/ motionentrance.edu.np
https://images.google.so/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://images.google.so/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/botanyleaf21/ --7sbarohhk4a0dxb3c.рф
https://www.google.co.ck/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect google.co.ck
https://wikimapia.org/external_link?url=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://wikimapia.org/external_link?url=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://maps.google.no/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.no
https://setiathome.berkeley.edu/show_user.php?userid=13247087 https://setiathome.berkeley.edu/show_user.php?userid=13247087
https://petsugar14.bravejournal.net/the-core-of-the-web petsugar14.bravejournal.net
https://tunepond09.bravejournal.net/pct-basics-a-practical-guide-to-nolvadex-clomid-and-hcg-after-cycling tunepond09.bravejournal.net
https://telegra.ph/An-In-Depth-Handbook-for-Planning-Anadrol-Cycles-10-08 telegra.ph
https://www.google.bs/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.bs/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
https://maps.google.fr/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect maps.google.fr
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623686 gaiaathome.eu
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623801 gaiaathome.eu
https://www.faax.org/author/drawerplanet91/ https://www.faax.org/
https://www.faax.org/author/loveepoxy31/ https://www.faax.org/
https://telegra.ph/Dianabol-Usage-Guide-Common-Questions-and-Safe-Use-Strategies-10-08 telegra.ph
https://motionentrance.edu.np/profile/raventruck4/ https://motionentrance.edu.np/profile/raventruck4/
https://www.google.co.mz/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://www.google.co.mz/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect
http://karayaz.ru/user/lankey2/ karayaz.ru
https://king-bookmark.stream/story.php?title=unlock-peak-power-the-ultimate-dianabol-cycle-%E2%80%93-titans%E2%80%99-go-to-steroid https://king-bookmark.stream/story.php?title=unlock-peak-power-the-ultimate-dianabol-cycle-–-titans’-go-to-steroid
https://autovin-info.com/user/plowsampan43/ autovin-info.com
https://may22.ru/user/braceice2/ may22.ru
http://humanlove.stream//index.php?title=kayayork5450 humanlove.stream
http://pattern-wiki.win/index.php?title=ballelindegaard7022 pattern-wiki.win
https://lejournaldedubai.com/user/briangrip77/ https://lejournaldedubai.com
http://www.annunciogratis.net/author/bumperitaly69 www.annunciogratis.net
https://lamb-jarvis-3.federatedjournals.com/balancing-act-how-the-equipoise-cycle-works-dosage-outcomes-and-potential-side-effects lamb-jarvis-3.federatedjournals.com
https://dupont-petersen-2.mdwrite.net/dianabol-cycle-achieving-optimal-outcomes-titans-top-choice-steroid dupont-petersen-2.mdwrite.net
http://pattern-wiki.win/index.php?title=wombleflindt3736 pattern-wiki.win
https://carroll-francis.federatedjournals.com/dianabol-demystified-pros-cons-and-cycle-strategies carroll-francis.federatedjournals.com
https://school-of-safety-russia.ru/user/wingcredit52/ https://school-of-safety-russia.ru
https://brandmoshaver.com/user/clavefront7/ brandmoshaver.com
https://prpack.ru/user/helpweek20/ https://prpack.ru/user/helpweek20
https://stevenscent94.werite.net/cycling-dianabol-a-bodybuilders-guide https://stevenscent94.werite.net
https://skitterphoto.com/photographers/1601858/mcdaniel-alford https://skitterphoto.com/photographers/1601858/mcdaniel-alford
https://www.24propertyinspain.com/user/profile/1235298 https://www.24propertyinspain.com/user/profile/1235298
https://ondashboard.win/story.php?title=test-e-deca-and-dbol-cycles-australian-bodybuilding-fitness-forum-review https://ondashboard.win
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1623494 gaiaathome.eu
http://pattern-wiki.win/index.php?title=haystillman0164 pattern-wiki.win
https://bbs.pku.edu.cn/v2/jump-to.php?url=https://www.valley.md/dianabol-before-and-after-results-you-can-expect bbs.pku.edu.cn
https://maps.google.com.ua/url?q=https://www.valley.md/dianabol-before-and-after-results-you-can-expect https://maps.google.com.ua/
https://stringsign4.bravejournal.net/whats-the-ideal-post-dianabol-recovery-plan https://stringsign4.bravejournal.net
https://nouvellessignet.space/item/406088 Valley.Md
https://gratisafhalen.be/author/firedchard74/ dianabol test
e cycle
https://prpack.ru/user/bookforest1/ dianabol sustanon cycle
https://king-wifi.win/wiki/Dianabol_Dbol_Cycle_Greatest_Options_For_Newbies_And_Superior_Users valley.md
https://dokuwiki.stream/wiki/Anavar_And_Test_Cycle_Benefits_Dosage_Unwanted_Effects_Optimal_Stacking_Information Dianabol and Testosterone cycle
https://imoodle.win/wiki/Anavar_Steroid_Cycle_Dosage_Unwanted_Effects_Anavar_For dianabol side effects after one cycle
http://hikvisiondb.webcam/index.php?title=phamtillman6836 winstrol dianabol cycle
https://rentry.co/ut8bveyd Injectable Dianabol Cycle
https://f1news.space/item/402925 4 Week Dianabol Cycle
https://personalbookmark.space/item/296457 how long Is
a dianabol cycle
https://xn---6-jlc6c.xn--p1ai/user/yakscent4/ Valley.md
https://enregistre-le.space/item/300385 dianabol cycle side
effects
https://f1news.site/item/405954 dianabol Deca cycle
https://cerealhead9.bravejournal.net/check-e-deca-dbol-cycle-australian-bodybuilding-and-health-discussion-board testosterone and dianabol cycle
https://topbookmarks.site/item/406196 testosterone trenbolone dianabol
cycle
http://www.stes.tyc.edu.tw/xoops/modules/profile/userinfo.php?uid=3621865 Dianabol Post
cycle
https://enregistre-le.space/item/300385 how to take dianabol first cycle
https://catsupquit1.bravejournal.net/prime-10-anadrol-cycles-for-bulking-and-cutting Valley.Md
http://hikvisiondb.webcam/index.php?title=nielsenspivey7881 what to
take after dianabol cycle
https://imoodle.win/wiki/Tren_E_Test_Dianabol_Bodybuilding_Forum tren dianabol test
cycle
https://classifieds.ocala-news.com/author/penmargin97 deca dianabol cycle
https://aryba.kg/user/vestaries2/ sustanon dianabol cycle
https://noticiasenvivo.site/item/403256 Sustanon and dianabol cycle
https://sciencewiki.science/wiki/Trenbolone_Acetate_An_Summary Winstrol
and dianabol cycle
https://xn----7sbarohhk4a0dxb3c.xn--p1ai/user/clubbudget1/ dianabol primobolan cycle
https://topbookmarks.xyz/item/302383 dianabol post cycle therapy
https://personalbookmark.space/item/296457 valley.md
https://newsagg.site/item/402738 dianabol and test cycle
https://topbookmarks.xyz/item/302249 valley.md
https://heavenarticle.com/author/firedpencil56-293105/ Valley.md
https://cameradb.review/wiki/Dbol_Cycle_Information_To_Stacking_Dosages_And_Side_Effects dianabol 10mg cycle
https://topbookmarks.xyz/item/302727 dianabol cycle side effects
https://www.colegioenlinea.edu.co/profile/mcleanxekcrews75859/profile dianabol Cycle only
https://f1news.site/item/405777 sustanon deca dianabol cycle
http://www.stes.tyc.edu.tw/xoops/modules/profile/userinfo.php?uid=3621865 what to
take after dianabol Cycle
https://peatix.com/user/27516124 Dianabol Primobolan Cycle
https://morphomics.science/wiki/Dianabol_And_Take_A_Look_At_Cycle_Guide_Results_Dosage dianabol cycle For beginners
https://fakenews.win/wiki/Dianabol_Dbol_Cycle_One_Of_The_Best_Choices_For_Newbies_And_Superior_Us Valley.Md
http://www.annunciogratis.net/author/circlemall44 Valley.Md
https://www.24propertyinspain.com/user/profile/1152194 Dianabol sustanon cycle
https://monjournal.space/item/404393 Dianabol And Testosterone Cycle
https://topbookmarks.cloud/item/404560 dianabol Cycle
https://imoodle.win/wiki/Anavar_Steroid_Cycle_Dosage_Unwanted_Effects_Anavar_For anavar dianabol cycle
https://penvoice18.bravejournal.net/dianabol-and-winstrol-cycle-dosage-advantages-and-unwanted-effects Valley.Md
https://aryba.kg/user/advicefeast8/ valley.Md
https://topbookmarks.xyz/item/302727 testosterone cypionate and dianabol cycle
http://09vodostok.ru/user/eventmale15/ deca and Dianabol cycle
https://topbookmarks.cloud/item/404705 dianabol cycles
https://scientific-programs.science/wiki/Dianabol_Dosage_For_Men_Bodybuilding_Steroid_Timing testosterone
and dianabol cycle
https://www.udrpsearch.com/user/priceradar5 Dianabol Tren Cycle
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1502841 dianabol and test
cycle
https://gaiaathome.eu/gaiaathome/show_user.php?userid=1502606 Valley.md
https://proxyrate.ru/user/quartcoffee50/ sustanon and dianabol cycle
https://opensourcebridge.science/wiki/Dianabol_Dbol_The_Ultimate_Word_Guide dianabol and deca cycle
http://www.mmgold.top:8103/kathikinsella2 http://www.mmgold.top
https://gitea.nongnghiepso.com/staciaknotts99 gitea.nongnghiepso.com
https://git.crudelis.kr/robbymolloy70 git.crudelis.kr
https://www.chembans.com/@koryespinoza4 www.chembans.com
https://www.besolife.com/@drusillahorn30 https://www.besolife.com/@drusillahorn30
https://kition.mhl.tuc.gr/carolepruitt74 kition.mhl.tuc.gr
http://bot.61ns.com:3000/alifreeleagus bot.61ns.com
https://utelectra.com/taren846940029 utelectra.com
https://git.rbsx.de/cassiemiller58 git.rbsx.de
https://git.rbsx.de/denisetrommler git.rbsx.de
https://www.soundofrecovery.org/marcygarret187 https://www.soundofrecovery.org
http://gite.limi.ink/clemmiebeaudoi gite.limi.ink
https://duanju.meiwang360.com/ivyo793692092 duanju.meiwang360.com
https://git.unglab.com/marycyr8301064 git.unglab.com
https://hiphopmusique.com/jamibourgeois3 https://hiphopmusique.com/
https://axc.duckdns.org:8091/nedcastillo849 https://axc.duckdns.org
https://git.sayndone.ru/gailhumphries8 git.sayndone.ru
https://gitea.zerova.com/eliascarner80 gitea.zerova.com
https://vcs.int.feuerwehr-ziemetshausen.de/hongsani039591 vcs.int.feuerwehr-ziemetshausen.de
https://gitlab.ui.ac.id/alvinbloomer65 https://gitlab.ui.ac.id/alvinbloomer65
https://gitea.fcliu.net/wilburkerr3732 https://gitea.fcliu.net
http://okbestgood.com:3000/juanitaanglin7 http://okbestgood.com
https://jovita.com/florchristie2 jovita.com
http://farsinot.ir:3000/willianmora573 http://farsinot.ir/
https://git.gaminganimal.org/hiltonratliff https://git.gaminganimal.org
https://git.karma-riuk.com/anitawertheim3 git.karma-riuk.com
https://nas.zearon.com:2001/jolenethorton4 nas.zearon.com
http://gitea.wholelove.com.tw:3000/ryanjcv3389791 gitea.wholelove.com.tw
https://www.jr-it-services.de:3000/margherita7953 https://www.jr-it-services.de
https://git.dihe.moe/ryanrobin25504 git.dihe.moe
https://zm.aosenhw.com/@tomokospeegle4 zm.aosenhw.com
https://git.connectplus.jp/florriecohn244 git.connectplus.jp
https://gitea.zerova.com/kandihenegar05 https://gitea.zerova.com/kandihenegar05
https://seychelleslove.com/@philomenavaler seychelleslove.com
http://git.fandiyuan.com/jacquesherndon git.fandiyuan.com
https://git.furcom.org/ciaragiffen17 https://git.furcom.org
https://lejournaldedubai.com/user/foxknife3/ lejournaldedubai.com
https://maps.google.com.sa/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://maps.google.com.sa
https://images.google.td/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects images.google.td
http://csmouse.com/user/veiltile1/ csmouse.com
https://peatix.com/user/27974270 peatix.com
https://linkvault.win/story.php?title=combining-bpc-157-and-kpv-a-revolutionary-approach-to-healing-in-juve-integrative-medicine-wellness linkvault.win
https://www.fionapremium.com/author/frenchpansy8/ fionapremium.com
https://justbookmark.win/story.php?title=bpc-157-peptide-a-naples-fl-doctor-explores-its-health-advantages justbookmark.win
http://humanlove.stream//index.php?title=sandovalmanning7583 humanlove.stream
https://maps.google.fr/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects maps.google.fr
https://school-of-safety-russia.ru/user/damageclerk8/ https://school-of-safety-russia.ru/
https://peatix.com/user/27974094 peatix.com
http://historydb.date/index.php?title=monahanlundgreen9722 historydb.date
https://images.google.com.my/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects images.google.com.my
https://muhammad-ali.com.az/user/causechild7/ muhammad-ali.com.az
http://xn----8sbec1b1ad1ae2f.xn--90ais/user/sailorfield2/ --8sbec1b1ad1ae2f.бел
http://okprint.kz/user/linedrain1/ http://okprint.kz
http://hikvisiondb.webcam/index.php?title=crowellaagaard2755 hikvisiondb.webcam
https://www.google.co.mz/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects www.google.co.mz
https://www.instapaper.com/p/16996813 www.instapaper.com
http://historydb.date/index.php?title=colonguerrero9085 http://historydb.date/index.php?title=colonguerrero9085
https://marshallcountyalabamademocraticparty.com/author/grasspruner7/ marshallcountyalabamademocraticparty.com
https://bookmark4you.win/story.php?title=kpv-peptide-advantages-and-potential-risks bookmark4you.win
https://www.24propertyinspain.com/user/profile/1237113 www.24propertyinspain.com
https://brandmoshaver.com/user/monthrun3/ brandmoshaver.com
https://gratisafhalen.be/author/dramageorge3/ gratisafhalen.be
http://humanlove.stream//index.php?title=carlsonfalkenberg6530 http://humanlove.stream//index.php?title=carlsonfalkenberg6530
https://www.argfx1.com/user/pantyplate4/ www.argfx1.com
https://images.google.co.il/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects images.google.co.il
https://www.bitsdujour.com/profiles/lNpRO9 www.bitsdujour.com
https://www.google.dm/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects google.dm
https://skitterphoto.com/photographers/1616329/clay-raynor https://skitterphoto.com/photographers/1616329/clay-raynor
https://brandmoshaver.com/user/windbaker1/ brandmoshaver.com
https://setiathome.berkeley.edu/show_user.php?userid=13252286 setiathome.berkeley.edu
http://09vodostok.ru/user/moneystar4/ 09vodostok.ru
https://justesen-neumann-2.blogbright.net/kpv-a-novel-therapeutic-peptide justesen-neumann-2.blogbright.net
https://autovin-info.com/user/datecolor6/ https://autovin-info.com/user/datecolor6
https://buketik39.ru/user/targetbank6/ buketik39.ru
http://lovewiki.faith/index.php?title=hickeystrauss6373 http://lovewiki.faith/index.php?title=hickeystrauss6373
https://images.google.co.il/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects images.google.co.il
https://www.google.sc/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://www.google.sc
https://silkrecord27.bravejournal.net/kpv-peptide-unveiling-its-role-in-accelerating-wound-healing silkrecord27.bravejournal.net
https://articlescad.com/revitalize-with-kpv-peptide-a-potent-anti-inflammatory-remedy-241997.html articlescad.com
https://glover-gaines-2.blogbright.net/kpv-peptide-a-brief-healing-guide glover-gaines-2.blogbright.net
https://brandmoshaver.com/user/makeuprecord08/ brandmoshaver.com
https://maps.google.com.ua/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://maps.google.com.ua/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects
https://www.google.bt/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects www.google.bt
https://maps.google.gg/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://maps.google.gg/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects
https://www.argfx1.com/user/pantyplate4/ argfx1.com
https://prpack.ru/user/steplock7/ prpack.ru
https://posteezy.com/revitalize-kpv-peptide-potent-anti-inflammatory-remedy posteezy.com
https://coolpot.stream/story.php?title=1-%E2%80%9Ckpv-unveiled-the-new-frontier-in-modern-warfare%E2%80%9D https://coolpot.stream/story.php?title=1-"kpv-unveiled-the-new-frontier-in-modern-warfare"
https://molchanovonews.ru/user/agendacredit5/ molchanovonews.ru
https://coolpot.stream/story.php?title=1-%E2%80%9Ckpv-unveiled-the-new-frontier-in-modern-warfare%E2%80%9D coolpot.stream
https://en.unidos.edu.uy/profile/degnwacklit81487/profile en.unidos.edu.uy
https://www.faax.org/author/paintshorts20/ www.faax.org
https://brandmoshaver.com/user/carpdrink2/ https://brandmoshaver.com/user/carpdrink2/
https://freebookmarkstore.win/story.php?title=%E2%80%9Cexploring-kpv-the-next-frontier-in-field%E2%80%9D https://freebookmarkstore.win/
https://may22.ru/user/edwardbrick2/ may22.ru
https://bom.so/Rrw1U1 bom.so
https://www.google.ki/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects www.google.ki
https://ebra.ewaucu.us/index.php?page=user&action=pub_profile&id=114446 ebra.ewaucu.us
https://lejournaldedubai.com/user/foxknife3/ https://lejournaldedubai.com/
https://skytte-karlsson.blogbright.net/possible-rewrites-of-kpv-peptide https://skytte-karlsson.blogbright.net
https://www.youtube.com/redirect?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://www.youtube.com/redirect?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects
https://www.rosewood.edu.na/profile/phelpsszwteague45117/profile https://www.rosewood.edu.na/profile/phelpsszwteague45117/profile
https://molchanovonews.ru/user/pikelyre1/ molchanovonews.ru
https://king-bookmark.stream/story.php?title=bpc-157-and-kpv-peptides-boosting-gut-wellness-through-anti-inflammatory-healing king-bookmark.stream
http://lovewiki.faith/index.php?title=thompsonbille1728 lovewiki.faith
https://images.google.com.gt/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects images.google.com.gt
https://gratisafhalen.be/author/dramageorge3/ https://gratisafhalen.be/author/dramageorge3
https://may22.ru/user/cookyard2/ may22.ru
https://fogh-rafn-3.mdwrite.net/kpv-peptide-perks-the-must-know-expert-handbook-for-2025 fogh-rafn-3.mdwrite.net
https://urlscan.io/result/0199c86c-e9e6-717a-a890-396b52fb90c1/ https://urlscan.io/result/0199c86c-e9e6-717a-a890-396b52fb90c1/
https://smp-arridhoplg.sch.id/author/congoslash6/ smp-arridhoplg.sch.id
https://lejournaldedubai.com/user/doublerecord07/ lejournaldedubai.com
https://ebra.ewaucu.us/index.php?page=user&action=pub_profile&id=114344 ebra.ewaucu.us
https://www.rosewood.edu.na/profile/phelpsszwteague45117/profile https://www.rosewood.edu.na
https://images.google.co.za/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://images.google.co.za/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects
https://telegra.ph/BPC-157-Risks-and-Safeguards-Essential-Information-Prior-to-Use-10-09 https://telegra.ph
https://skytte-karlsson.blogbright.net/possible-rewrites-of-kpv-peptide skytte-karlsson.blogbright.net
https://loft-cervantes-2.technetbloggers.de/kpv-capsules-a-new-frontier-in-performance-enhancement loft-cervantes-2.technetbloggers.de
https://setiathome.berkeley.edu/show_user.php?userid=13252073 https://setiathome.berkeley.edu/
https://images.google.as/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://images.google.as/
https://brandmoshaver.com/user/stormgolf0/ brandmoshaver.com
https://www.udrpsearch.com/user/litterwalk9 www.udrpsearch.com
https://may22.ru/user/cookyard2/ may22.ru
http://king-wifi.win//index.php?title=lambertdalton6852 http://king-wifi.win//index.php?title=lambertdalton6852
https://rentry.co/wert5s3n rentry.co
https://skitterphoto.com/photographers/1616329/clay-raynor skitterphoto.com
https://www.google.co.mz/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects www.google.co.mz
https://www.udrpsearch.com/user/alleydate1 https://www.udrpsearch.com/
http://stroyrem-master.ru/user/rugbygrease03/ stroyrem-master.ru
https://images.google.co.il/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://images.google.co.il/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects
https://prpack.ru/user/wrenchalley9/ prpack.ru
https://www.24propertyinspain.com/user/profile/1237131 https://www.24propertyinspain.com
https://firsturl.de/L02Pn79 https://firsturl.de/L02Pn79
http://mozillabd.science/index.php?title=braswellherrera7751 mozillabd.science
https://www.google.pt/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects google.pt
http://hikvisiondb.webcam/index.php?title=crowellaagaard2755 hikvisiondb.webcam
https://firsturl.de/G7L6tUL firsturl.de
https://brandmoshaver.com/user/windbaker1/ brandmoshaver.com
https://lejournaldedubai.com/user/cookstar7/ lejournaldedubai.com
http://09vodostok.ru/user/napkinbrand5/ http://09vodostok.ru/user/napkinbrand5/
https://graph.org/BPC-157-Side-Effects-All-the-Key-Information-You-Should-Have-10-09 graph.org
https://setiathome.berkeley.edu/show_user.php?userid=13252139 setiathome.berkeley.edu
https://maps.google.com.sa/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects https://maps.google.com.sa/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects
https://maps.google.ae/url?q=https://www.valley.md/kpv-peptide-guide-to-benefits-dosage-side-effects maps.google.ae
https://rc.intaps.com/abelanderton1/abel2018/wiki/Dianabol-Tablets%3A-Essential-Guide-For-First-Time-Buyers-And-Safe-Usage https://rc.intaps.com/
http://geekhosting.company/savannaharchda geekhosting.company
http://git.biscicloud.com/malissameadows git.biscicloud.com
https://www.toparma.com/arianneedmunds www.toparma.com
https://git.yuhong.com.cn/nxnperry920868 https://git.yuhong.com.cn/nxnperry920868
https://newsflip.in/@corakasper3640?page=about newsflip.in
https://git.cbrx.io/fannyfernandez git.cbrx.io
https://git.jjunho.org/norinelorenzo8 https://git.jjunho.org/
https://kition.mhl.tuc.gr/nhrbryce887297 kition.mhl.tuc.gr
https://kition.mhl.tuc.gr/nhrbryce887297 kition.mhl.tuc.gr
https://date.ainfinity.com.br/@caitlindelvall date.ainfinity.com.br
https://freevideocanal.com/@houstonw198857?page=about https://freevideocanal.com
http://hot360onlinetv.site/@tommyking8277?page=about http://hot360onlinetv.site
https://git.jamieede.com/tanja726075808 https://git.jamieede.com
https://dyln.fun/bradyqrc03482 https://dyln.fun/bradyqrc03482
https://camtalking.com/@laifawn504189 camtalking.com
https://www.nemusic.rocks/jenniefiorillo www.nemusic.rocks
https://gitea.synapsetec.cn/georginacorder gitea.synapsetec.cn
https://zm.aosenhw.com/@trudiclements https://zm.aosenhw.com/@trudiclements
http://git.7doc.com.cn/ashlicawthorn git.7doc.com.cn
https://newborhooddates.com/@porterverco793 newborhooddates.com
https://git.penwing.org/harlancheongch/6726207/wiki/Dianabol-Cycle%3A-FAQs-And-Harm-Reduction-Protocols git.penwing.org
https://gosvid.com/@estellemedley?page=about gosvid.com
https://git.techspec.pro/vicentel396800/vicente1982/wiki/Dianabol-Cycle:-FAQs-And-Harm-Reduction-Protocols git.techspec.pro
https://git.anorz.com/dorinefreeleag git.anorz.com
https://myclassictv.com/@esmeraldacapas?page=about https://myclassictv.com/
https://git.bremauer.cc/carleyl588750 git.bremauer.cc
https://app.fitlove.app/@romainepenney app.fitlove.app
https://gitea.aetoskia.com/lanopitz49924 gitea.aetoskia.com
https://repo.komhumana.org/jerecohn421447 repo.komhumana.org
https://cutenite.com/@faeisbell12882 https://cutenite.com/@faeisbell12882
https://loveis.app/@gracielagerald https://loveis.app/
https://k8cutv01.it.ntnu.no/lupekingsley11 k8cutv01.it.ntnu.no
http://gitlab.alpaedu.co.kr:8000/carolinemckedd gitlab.alpaedu.co.kr
http://okbestgood.com:3000/pilarokeefe23 http://okbestgood.com/
https://learninghub.fulljam.com/@qlhconcepcion1?page=about https://learninghub.fulljam.com
https://apnatube.in/@lawerencemcdon?page=about apnatube.in
https://nrimatchmaking.com/@jani48s5995559 https://nrimatchmaking.com
http://provision-sa.co.za:3000/calebpettiford/2458date.etogetherness.com/wiki/Best-Dianabol-Dbol-Pills-2025%3A-For-Sale%2C-Dianabol-Cycle-And-Dosage%3F provision-sa.co.za
https://proputube.com/@melanieveitch?page=about https://proputube.com/@melanieveitch?page=about
http://geekhosting.company/elisabethharit http://geekhosting.company/elisabethharit
https://occ.orioncode.sg/read-blog/47614_the-heart-of-the-internet.html https://occ.orioncode.sg/
https://git.cymnb.com/madgecockle091 https://git.cymnb.com/madgecockle091
https://www.sugarmummyx.com/@wilfredo83x65?page=about https://www.sugarmummyx.com/@wilfredo83x65?page=about
http://nas.bi1kbu.com:8418/muhammadx72616 nas.bi1kbu.com
https://nucleation.fusion.bref.cool/deneengillis9 nucleation.fusion.bref.cool
https://gitea.nongnghiepso.com/katherinaanton gitea.nongnghiepso.com
https://duanju.meiwang360.com/halcornett8657 https://duanju.meiwang360.com/halcornett8657
https://gog.taletrail.fi/aurorajgw39992 gog.taletrail.fi
https://blackbirdstory.com/@manualnoguera8?page=about https://blackbirdstory.com
https://video.office.saltworks.pl/@ralfgoulet9833?page=about video.office.saltworks.pl
https://iconpath.ng/read-blog/30_buy-dianabol-dbol-pills-2025-d-bal-benefits-amp-dosage-guide.html https://iconpath.ng/read-blog/30_buy-dianabol-dbol-pills-2025-d-bal-benefits-amp-dosage-guide.html
http://okbestgood.com:3000/sheritacranswi okbestgood.com
https://kf.hebrewconnect.tv/@jamalbonner26?page=about https://kf.hebrewconnect.tv/@jamalbonner26?page=about
http://dgzyt.xyz:3000/jamijemison482 dgzyt.xyz
https://tippy-t.com/melvamedeiros tippy-t.com
https://afritunes.net/skye36f7234689 afritunes.net
http://git.linkupx.com/vvxmercedes441 git.linkupx.com
http://gitea.danongshu.cn/nataliavallejo gitea.danongshu.cn
https://maintain.basejy.com/jasmineloton54 maintain.basejy.com
https://m.hrjh.org/juanaskew71634 m.hrjh.org
https://git.techspec.pro/virgiliowillhi git.techspec.pro
http://boiler.ttoslinux.org:8888/veroniquehale/veronique1982/-/issues/1 boiler.ttoslinux.org
https://www.hyzq123.com/@mvbchas5533179?page=about hyzq123.com
https://git.rikkei.edu.vn/alfonsomcmann8 git.rikkei.edu.vn
https://www.lizyum.com/@coraldibella91 https://www.lizyum.com/
https://nychat.in/read-blog/15_in-brief-using-steroids-correctly-and-avoiding-side-effects-informedhealth-org-n.html nychat.in
https://gitlab.innive.com/sophiahowe774 https://gitlab.innive.com/sophiahowe774
https://axc.duckdns.org:8091/alvarojeffcott axc.duckdns.org
https://rapid.tube/@brandibelt1254?page=about https://rapid.tube
https://gogs.yinbin.ink:8/iancurrey74457 gogs.yinbin.ink
https://git.penwing.org/verna32k42362 https://git.penwing.org
http://gitea.yunshanghub.com:8081/hueyroan950246 gitea.yunshanghub.com
https://cineraworld.com/@albamarrufo143?page=about https://cineraworld.com
https://finalresult.buzz/tameragooge012 https://finalresult.buzz/
http://cwqserver.online:3000/erikasterne509 cwqserver.online
https://git.rankenste.in/evieclayton65 git.rankenste.in
https://pattayavids.com/@maxwell78i9844?page=about https://pattayavids.com
https://video.cheeft.com/@dawngiorza4563?page=about video.cheeft.com
https://movieplays.net/@vernonryder276?page=about movieplays.net
https://srsbkn.eu.org/ofeliasolis04 srsbkn.eu.org
https://gitea.tryinvisia.us/lupitacollee54 https://gitea.tryinvisia.us/
http://gitlab.pingtech.net/lea57893542010 gitlab.pingtech.net
https://maru.bnkode.com/@genesismaccart maru.bnkode.com
https://git.bp-web.app/morrisheyer560/lesla.com4940/wiki/Deca-Durabolin%3A-Uses%2C-Benefits%2C-And-Side-Effects git.bp-web.app
https://aitnas.myasustor.com/sheriyount3411 aitnas.myasustor.com
https://git.mtapi.io/jewellsalter09 https://git.mtapi.io/jewellsalter09
https://niubillity.com:3000/paulinaaylward/paulina1991/wiki/Dianabol+Dbol%253A+The+Ultimate+Guide niubillity.com
http://git.suxiniot.com/marshafellows4 http://git.suxiniot.com/marshafellows4
https://yooverse.com/@thorstenwhite yooverse.com
https://vydiio.com/@cortezkeefer77?page=about vydiio.com
https://git.arx-obscura.de/shirleyralston https://git.arx-obscura.de/shirleyralston
https://camtalking.com/@laifawn504189 camtalking.com
https://xajhuang.com:3100/maegottschalk9 https://xajhuang.com:3100/maegottschalk9
https://www.pulaplay.com/@danellestickle?page=about www.pulaplay.com
https://gogs.dev.dazesoft.cn/qmlmerlin14650 https://gogs.dev.dazesoft.cn/qmlmerlin14650
http://www.zjzhcn.com/finleyhussey4 http://www.zjzhcn.com/finleyhussey4
https://vidspaceaiapp.com/@charleyregan0?page=about https://vidspaceaiapp.com/@charleyregan0?page=about
https://musixx.smart-und-nett.de/chadwickeichho musixx.smart-und-nett.de
http://meloopbd.com/read-blog/950_how-to-buy-dbol-the-king-of-bulking-steroids.html meloopbd.com
https://gitea.morawietz.dev/stephansealey6 https://gitea.morawietz.dev
https://mobishorts.com/@mikaylavanzett?page=about mobishorts.com
https://www.flexsocialbox.com/read-blog/57312_the-heart-of-the-internet.html www.flexsocialbox.com
http://nas.zeroj.net:3000/lane33l6719733/lane2006/wiki/Dbol+Pills+Benefits+In+2025%253A+Muscle+Growth%252C+Dosage+%2526+Safe+Use+Guide nas.zeroj.net
https://code.swecha.org/ericragland47 code.swecha.org
http://ggzypz.org.cn:8664/willian5030621 http://ggzypz.org.cn:8664/willian5030621
https://git.toot.pt/lavadasigel80 https://git.toot.pt/
https://www.meetgr.com/@lorettamidgett https://www.meetgr.com/@lorettamidgett
https://hooyahoo.net/read-blog/23125_dianabol-cycle.html hooyahoo.net
https://git.rec4box.com/jurgenshoemake https://git.rec4box.com/
https://truesecret.org/@richkoerstz504?page=about https://truesecret.org/
http://git.chelingzhu.com/gerardoquinlan http://git.chelingzhu.com/gerardoquinlan
http://gitlab.juncdt.com:3001/danafrizzell8 gitlab.juncdt.com
https://devops.rs2i.fr/namharr6901362 devops.rs2i.fr
https://viddertube.com/@nigelcantero6?page=about https://viddertube.com
http://gitea.aibaytek.com/calvinsmythe76 gitea.aibaytek.com
https://giteap.grobest.com:3000/hilario48o298 giteap.grobest.com
https://iamtube.jp/@jonibone906735?page=about https://iamtube.jp
https://git.hexdive.com/adolfonowak782 https://git.hexdive.com/adolfonowak782
https://gitlab.kwant-project.org/jeffersontoliv https://gitlab.kwant-project.org/
https://git.yi-guanjia.com/agnesnct74970 https://git.yi-guanjia.com/agnesnct74970
http://tigerpi.cn:3000/candy61g273987 tigerpi.cn
https://datez.pro/@archie77s12579 https://datez.pro/@archie77s12579
https://git.daneric.dev/carissaleroy53 git.daneric.dev
https://liv07.com.np/@priscillay0879?page=about liv07.com.np
https://shiatube.org/@patwragge48361?page=about https://shiatube.org
https://gitea.svc.obaa.cloud/sashaplayford https://gitea.svc.obaa.cloud/
https://theprome.com/read-blog/39201_dianabol-turinabol-cycle-plan-pdf.html https://theprome.com
https://wiwonder.com/read-blog/50179_first-steroid-cycle-beginners-guide-to-safe-steroid-cycling.html wiwonder.com
https://orkutbook.com/read-blog/6326_deca-durabolin-cycle-side-effects-risks-stacks-and-alternatives.html orkutbook.com
https://ebonyiansindiaspora.org/read-blog/1544_how-to-buy-dbol-the-king-of-bulking-steroids.html ebonyiansindiaspora.org
https://playbaux.com/@haydentempleto?page=about https://playbaux.com/@haydentempleto?page=about
http://tangxj.cn:6012/philomenaconte tangxj.cn
https://gogs.dev.dazesoft.cn/bertiestandley gogs.dev.dazesoft.cn
http://dengle.cc:3000/nealkinsella23 http://dengle.cc:3000/nealkinsella23
https://git.17pkmj.com:3000/autumn28i7783 git.17pkmj.com
https://git.hanckh.top/elden79947969 git.hanckh.top
https://gitea.johannes-hegele.de/lawerencekmr7 gitea.johannes-hegele.de
https://gitea.carmon.co.kr/irvinf77526634 https://gitea.carmon.co.kr
https://git.ides.club/danaemerz85716 https://git.ides.club
https://git.el-paco.com/melvaseppelt17 https://git.el-paco.com/melvaseppelt17
http://git.fast-fun.cn:92/ricoheiman641 http://git.fast-fun.cn:92/ricoheiman641
https://gogs.qindingtech.com/romahoughton2 gogs.qindingtech.com
https://gogs.artapp.cn/janeenlynch22/afrotapes.com2012/wiki/Anabolic+Steroids%253A+Uses%252C+Abuse%252C+And+Side+Effects https://gogs.artapp.cn
https://git.juici.ly/dirkbrendel940 https://git.juici.ly
https://git.simnet.cx/gertiemckibben https://git.simnet.cx/gertiemckibben
http://www.we-class.kr/juanalcala1453/4233sithcom.de/-/issues/1 http://www.we-class.kr/juanalcala1453/4233sithcom.de/-/issues/1
http://gitlab.pingtech.net/patriciadrenna gitlab.pingtech.net
http://www.geto.space/read-blog/29245_effects-of-dianabol-and-high-intensity-sprint-training-on-body-composition-of-ra.html www.geto.space
https://hiphopmusique.com/tracimaldonado https://hiphopmusique.com
http://www.factory18.cn/ron83f79153077 www.factory18.cn
https://git.mopsovi.cloud/rgejill0245722 git.mopsovi.cloud
http://fort23.cn:3000/julianevandyke fort23.cn
https://git.olyntec.com/justinesalcedo git.olyntec.com
http://www.lx-device.com:3000/domingorubbo26 http://www.lx-device.com:3000/domingorubbo26
https://git.toot.pt/lavadasigel80 git.toot.pt
https://mayvideo.in/@geraldineslagl?page=about mayvideo.in
https://seychelleslove.com/@willisiacovell seychelleslove.com
https://git.cloud.leonclassroom.com/taylascaddan71/git.traband.ovh2007/wiki/Steroids-Dbol-And-Primo-Cycle git.cloud.leonclassroom.com
https://mobishorts.com/@mikaylavanzett?page=about https://mobishorts.com/@mikaylavanzett?page=about
https://gitlab.cranecloud.io/jeremiahwill63 gitlab.cranecloud.io
https://tovegans.tube/@ellise55536012?page=about tovegans.tube
https://gitea.offends.cn/deidremillingt https://gitea.offends.cn/deidremillingt
https://aiviu.app/@reaganburbury2?page=about aiviu.app
https://yaseen.tv/@reinawildermut?page=about https://yaseen.tv/@reinawildermut?page=about
https://git.malls.iformall.com/andrewq0745972 git.malls.iformall.com
https://lekoxnfx.com:4000/francinepenrod/6418888/wiki/5+Best+Anabolic+Stacks+And+Steroids+For+Beginners lekoxnfx.com
https://git.pasarex.com/joeebersbacher https://git.pasarex.com/joeebersbacher
https://blackbirdstory.com/@manualnoguera8?page=about blackbirdstory.com
https://git.taglang.io/windy60g68712 https://git.taglang.io
https://newsflip.in/@eleanororlandi?page=about https://newsflip.in
https://gitea.springforest.top/shelbyheymann https://gitea.springforest.top
https://massivemiracle.com/@dotty710962908?page=about https://massivemiracle.com/
http://aimusicitalia.it/klausstruthers aimusicitalia.it
https://gitlab.rightease.com:443/jillt149666540 gitlab.rightease.com
https://tube.denthubs.com/@chukreitmayer?page=about tube.denthubs.com
https://freshteenclips.com/@betseypiddingt?page=about freshteenclips.com
https://git.cymnb.com/madgecockle091 git.cymnb.com
https://www.appleradish.org/lakesharpl0898 https://www.appleradish.org/lakesharpl0898
https://www.fastmarry.com/@antonettacoleb https://www.fastmarry.com/@antonettacoleb
https://gitea.gimmin.com/bennie89u46469 gitea.gimmin.com
https://poptop.online/read-blog/11818_the-heart-of-the-internet.html poptop.online
https://gogs.artapp.cn/stephen87k034 https://gogs.artapp.cn/stephen87k034
https://git.srblerp.com/ellenboxall72 https://git.srblerp.com
https://gitea.xy88.fun/gitagreenleaf2 gitea.xy88.fun
https://git.yi-guanjia.com/agnesnct74970 git.yi-guanjia.com
https://supartube.com/@isidralambrick?page=about supartube.com
https://poptop.online/read-blog/11817_dianabol-dbol-cycle-guide-results-side-effects-and-dosage.html poptop.online
https://webba.cz/@mandybreen5179?page=about https://webba.cz/
https://git.forum.ircam.fr/rexfatnowna24/7829git.sgap.uk/-/issues/1 git.forum.ircam.fr
https://gitea.belanjaparts.com/claricemccalli https://gitea.belanjaparts.com/claricemccalli
https://git.7vbc.com/keisha09d33286 git.7vbc.com
https://sensualmarketplace.com/read-blog/34137_bulking-cycle-10-weeks-pdf.html sensualmarketplace.com
https://musixx.smart-und-nett.de/fletap34573005 https://musixx.smart-und-nett.de
https://gitea.fcliu.net/franziskam8443 https://gitea.fcliu.net
https://www.ituac.com/valencia927577 www.ituac.com
https://git.outsidecontext.solutions/fcvsheena18202/4077739/wiki/Dianabol-Cycle-Pharma-TRT git.outsidecontext.solutions
https://worldclassdjs.com/traceegainer96 https://worldclassdjs.com
http://nas.bi1kbu.com:8418/muhammadx72616 nas.bi1kbu.com
https://mmctube.com/@rodgersten707?page=about https://mmctube.com
https://web.panda.id/read-blog/6999_testosterone-enanthate-dianabol-first-cycle-pharma-trt.html web.panda.id
http://code.kfw.net/elissa01j1747 code.kfw.net
https://git.parat.swiss/sherlyn5087244 git.parat.swiss
https://vidmero.com/@jorgalonso6507?page=about vidmero.com
https://gogs.ra-solutions.de/marcelashaver7 https://gogs.ra-solutions.de/marcelashaver7
https://orailo.com/@yasminchristma orailo.com
https://www.cloud.file.futurestack.cn/vernitarodarte www.cloud.file.futurestack.cn
http://git.chelingzhu.com/gerardoquinlan git.chelingzhu.com
http://smandamlg.com/vibe/@jeannettemickl?page=about smandamlg.com
https://git.zimerguz.net/katherina58x84 git.zimerguz.net
https://git.daneric.dev/carissaleroy53 git.daneric.dev
http://dgzyt.xyz:3000/clayfindlay200 http://dgzyt.xyz
https://devkona.net/veronicalucia devkona.net
https://homeview.emmcoc.com.ng/@jerilyn47z8387?page=about homeview.emmcoc.com.ng
https://matchmadeinasia.com/@dantelcv983280 https://matchmadeinasia.com/@dantelcv983280
https://healthbookbd.com/read-blog/17451_anabolic-steroids-uses-side-effects-and-alternatives.html https://healthbookbd.com
https://inmessage.site/@mdxrosetta403 inmessage.site
https://code.dsconce.space/marcial020802 code.dsconce.space
https://git.gonstack.com/dessietrigg416 https://git.gonstack.com/dessietrigg416
https://git.nightime.org/buddysanor7821 git.nightime.org
http://www.tdss.website:801/rorysellar1000 http://www.tdss.website:801/rorysellar1000
https://git.auwiesen2.de/maplehollway85 https://git.auwiesen2.de/maplehollway85
http://tfjiang.cn:32773/kris7162893340 tfjiang.cn
https://videos.awaregift.com/@maura90n05378?page=about videos.awaregift.com
https://www.aservicehost.ru/malindacoldiro www.aservicehost.ru
https://play.dental.cx/@charlad0197188?page=about https://play.dental.cx
https://viblio.in/read-blog/32_dianabol-cycle-faqs-and-harm-reduction-protocols.html https://viblio.in/read-blog/32_dianabol-cycle-faqs-and-harm-reduction-protocols.html
https://theudtaullu.com/@fannieraynor0?page=about https://theudtaullu.com/
https://demo.safecircle.family/read-blog/13529_what-are-the-risks-of-steroid-use-for-teens.html demo.safecircle.family
http://www.zjzhcn.com/finleyhussey4 www.zjzhcn.com
https://gitea.mulberrypos.ru/lachlan10v1787 https://gitea.mulberrypos.ru/lachlan10v1787
https://deltasongs.com/tammaragleadow https://deltasongs.com/tammaragleadow
https://kahkaham.net/read-blog/130725_dianabol-dbol-the-ultimate-guide.html https://kahkaham.net/read-blog/130725_dianabol-dbol-the-ultimate-guide.html
https://aipair.io/read-blog/15840_more-middle-aged-men-taking-steroids-to-look-younger-men-039-s-health.html https://aipair.io
https://code.miraclezhb.com/tawnyamckellar https://code.miraclezhb.com/tawnyamckellar
https://gt.clarifylife.net/meidelgado010 gt.clarifylife.net
https://git.agusandelnorte.gov.ph/akilah60x97234 https://git.agusandelnorte.gov.ph
https://git.9ig.com/peteabe808545 git.9ig.com
https://gitlab.edebe.com.br/efrenbellasis6/8696347/-/issues/1 https://gitlab.edebe.com.br
https://code.swecha.org/daltondial5973 code.swecha.org
https://www.nxgit.xyz/bethanylau0888 www.nxgit.xyz
https://tiktoksi.com/read-blog/51_from-mr-average-to-superman-health-amp-wellbeing.html tiktoksi.com
https://alelo.org/@bella16515711 alelo.org
https://likeminds.fun/read-blog/69297_top-7-testosterone-cycles-the-ultimate-stacking-guide.html likeminds.fun
https://www.broutube.com/@glennagivens74?page=about https://www.broutube.com/@glennagivens74?page=about
http://www.juxinshuzhi.com/petraedw378916 http://www.juxinshuzhi.com/
https://gitlab.innive.com/latanyaeddie60 https://gitlab.innive.com
https://orkutbook.com/read-blog/6330_metandienone-wikipedia.html https://orkutbook.com/
https://git.homains.org/isabellelima78/5497gitea.aetoskia.com/wiki/Dbol+Cycle%253A+Guide+To+Stacking%252C+Dosages%252C+And+Side+Effects git.homains.org
https://gitea.marvinronk.com/rosariawillis9 gitea.marvinronk.com
https://git.zhukovsky.me/brandongreenha git.zhukovsky.me
https://code.openmobius.com:3001/blairhays8574 https://code.openmobius.com:3001/blairhays8574
https://itimez.com/@carmonbloom388?page=about itimez.com
https://git.maiasoft.jp/jonnietout5576 https://git.maiasoft.jp
https://supardating.com/@beaumilliken64 supardating.com
https://spinvai.com/wilhelminamuri spinvai.com
https://russiatube.com/@junesharrow34?page=about russiatube.com
http://git.yanei-iot.com:600/madelineberk3 http://git.yanei-iot.com
https://git.pasarex.com/shantellrossi0 git.pasarex.com
https://git.gonstack.com/daciaholler999 git.gonstack.com
http://git.qiniu1314.com/kristianborthw http://git.qiniu1314.com
https://music.magic-pics.tk/esmeralda4387 https://music.magic-pics.tk/esmeralda4387
https://newsflip.in/@aleidagoodin26?page=about newsflip.in
http://spnewstv.com/@paulinebayles?page=about spnewstv.com
https://git.wun.im/rooseveltpococ https://git.wun.im/
https://social.oneworldonesai.com/read-blog/56045_dbol-results-in-bodybuilding-cycles-and-stacks.html social.oneworldonesai.com
https://snorix.org/read-blog/6199_more-middle-aged-men-taking-steroids-to-look-younger-men-039-s-health.html snorix.org
http://huwhois.cn:3000/elwoodtatum249 huwhois.cn
https://git.complic.cloud/winstonjoris79 git.complic.cloud
https://facerelation.com/read-blog/12246_sustanon-250-cycle-guide-top-6-stacks-with-dosages.html https://facerelation.com/read-blog/12246_sustanon-250-cycle-guide-top-6-stacks-with-dosages.html
https://esvoe.video/@karryvaccari6?page=about esvoe.video
https://git.penwing.org/harlancheongch git.penwing.org
https://bluebirdmusic.in/@nellywentz5262?page=about bluebirdmusic.in
https://sound.gatzone.com/randalkeighley https://sound.gatzone.com/randalkeighley
https://git.emanuelemiani.it/blakemcgahan4 https://git.emanuelemiani.it/blakemcgahan4
https://git.hexaquo.at/rosella3799086 https://git.hexaquo.at
https://git.bp-web.app/morrisheyer560 git.bp-web.app
http://wangchongwu.vicp.fun:3333/phillipcolloco wangchongwu.vicp.fun
https://sistemagent.com:8081/fredmattingly https://sistemagent.com
https://vydiio.com/@ktfmarissa9867?page=about vydiio.com
http://git.linkupx.com/ezumia8830679 git.linkupx.com
https://vidmero.com/@donnieshultz55?page=about https://vidmero.com/@donnieshultz55?page=about
https://www.italia24.tv/tube/@erikash3437390?page=about www.italia24.tv
https://git.agusandelnorte.gov.ph/daisycrowder65 https://git.agusandelnorte.gov.ph/daisycrowder65
http://geekhosting.company/bradleyahrens4 geekhosting.company
http://dengle.cc:3000/ubzgertie7635 http://dengle.cc:3000/ubzgertie7635
https://sing.ibible.hk/@ulyssescormier?page=about https://sing.ibible.hk/
https://revenu.live/@noreene6413162?page=about https://revenu.live/@noreene6413162?page=about
http://okbestgood.com:3000/latiaruse69716 okbestgood.com
https://samsabz.ir/demitindal7561 https://samsabz.ir/demitindal7561
https://git.bloade.com/ankepurser3622 git.bloade.com
http://iskame.bg.cm/@joie78e2152062 http://iskame.bg.cm/
https://naijasingles.net/@rodparson6862 naijasingles.net
https://git.el-paco.com/elisalesouef98 git.el-paco.com
https://git.van-peeren.de/joeylam1532369 https://git.van-peeren.de/joeylam1532369
https://thewerffreport.com/@saulsainthill0?page=about https://thewerffreport.com
https://cuckoldesposas.com/@warrenchaney1?page=about cuckoldesposas.com
https://git.lakaweb.com/dorisa67081690 git.lakaweb.com
https://snaytube.com/@johnnystine257?page=about snaytube.com
http://git.linkupx.com/vvxmercedes441 git.linkupx.com
https://movieru.jp/portfolio/@donhwn0440208?page=about https://movieru.jp
https://srsbkn.eu.org/elinor99199459 srsbkn.eu.org
https://seychelleslove.com/@issacworthingt seychelleslove.com
https://gitea.synapsetec.cn/aishablackman gitea.synapsetec.cn
https://git.unicom.studio/lola47z4895901 https://git.unicom.studio
https://slowdating.ca/@dojwillie9015 https://slowdating.ca/@dojwillie9015
http://rm.runfox.com/gitlab/leopoldodalley http://rm.runfox.com/
https://orailo.com/@brunoj98147028 orailo.com
https://gitea.geekelectronick.com/ernestinesills gitea.geekelectronick.com
https://cutenite.com/@pearlenepascal cutenite.com
https://gitlab.catamarca.gob.ar/u/quincysuggs842 https://gitlab.catamarca.gob.ar/u/quincysuggs842
https://video.cheeft.com/@preciousgaithe?page=about video.cheeft.com
https://twoheartsagency.com/@zmjirving44295 twoheartsagency.com
http://gitlab.dev.jtyjy.com/jeffqde3367906 gitlab.dev.jtyjy.com
https://git.unicom.studio/charlenelett63 git.unicom.studio
https://naijasingles.net/@fosterderrick7 naijasingles.net
http://yin520.cn:3000/betseyraley06 http://yin520.cn:3000/betseyraley06
https://theindietube.com/@dallasfavela4?page=about theindietube.com
https://yaseen.tv/@kimberlysevera?page=about yaseen.tv
https://lius.familyds.org:3000/selmatha102122 lius.familyds.org
https://git.4lcap.com/soila40n922566 git.4lcap.com
https://askmilton.tv/@shadventura200?page=about askmilton.tv
https://git.olyntec.com/uwtalonzo6307 git.olyntec.com
http://git.jishutao.com/vgidebbra67153 git.jishutao.com
http://git.liubeiting.cn:8000/redahadley8350 git.liubeiting.cn
https://koseongnam.com/carmellareynel koseongnam.com
http://www.mmgold.top:8103/alisiakroemer http://www.mmgold.top/
https://git.hexdive.com/diego55p01449 https://git.hexdive.com/diego55p01449
https://www.xtrareal.tv/@josephdykes80?page=about https://www.xtrareal.tv/@josephdykes80?page=about
https://karnena.com/mdtchasity9293 karnena.com
https://camtalking.com/@shawnnewling77 camtalking.com
https://gitea.shirom.me/enidstephensen gitea.shirom.me
https://videos.awaregift.com/@berryfulkerson?page=about https://videos.awaregift.com/@berryfulkerson?page=about
https://gitea.visoftware.com.co/berndjowett540 gitea.visoftware.com.co
https://git.17pkmj.com:3000/elvinbisbee01 https://git.17pkmj.com:3000/elvinbisbee01
http://git.7doc.com.cn/stephany050238 git.7doc.com.cn
https://www.chembans.com/@hildredcothran www.chembans.com
https://gitea.xtometa.com/kelsey12y28576 gitea.xtometa.com
https://gitea.mulberrypos.ru/tuyetsticht132 gitea.mulberrypos.ru
https://maru.bnkode.com/@kurtbembry2730 https://maru.bnkode.com
https://gitea.ysme.top/sondrafrederic gitea.ysme.top
https://gitiplay.com/@marciawinters?page=about gitiplay.com
https://mardplay.com/omarwhitehead9 mardplay.com
https://vigilanteapp.com/@finlaystenhous?page=about vigilanteapp.com
https://git.yuhong.com.cn/ariannemckee34 git.yuhong.com.cn
https://www.nxgit.xyz/kraigcch701940 https://www.nxgit.xyz/kraigcch701940
https://www.latflex.net/@owenesteban910?page=about www.latflex.net
https://gitea.zerova.com/brendaswart60 gitea.zerova.com
https://git.51aspx.com/lindascribner8 git.51aspx.com
https://git.karma-riuk.com/luther60y08032 git.karma-riuk.com
https://git.wisder.net/olgabower06602 git.wisder.net
http://jinhon-info.com.tw:3000/barbradarrell3 jinhon-info.com.tw
https://datebaku.com/@marlamcarthur datebaku.com
https://katibemaraty.com/@kelleykauper8?page=about katibemaraty.com
https://mahalkita.ph/@bethanymartins https://mahalkita.ph
https://maintain.basejy.com/veramulga63171 https://maintain.basejy.com
https://www.musicsound.ca/erlindatemplet www.musicsound.ca
https://git.bp-web.app/marshallparmer git.bp-web.app
https://pod.tek.us/@erkvalerie397?page=about pod.tek.us
https://vidstreamr.com/@norinesherlock?page=about vidstreamr.com
https://git.connectplus.jp/garrycoons6401 https://git.connectplus.jp/garrycoons6401
https://lensez.info/abbeyhankins5 lensez.info
https://mahalkita.ph/@fidelfoy16615 https://mahalkita.ph/@fidelfoy16615
https://git.aelhost.com/nigelmerriam35 git.aelhost.com
https://mzansinyash.com/@elliotmoser537?page=about https://mzansinyash.com
https://mahalkita.ph/@fidelfoy16615 mahalkita.ph
https://aipod.app/matthiaswunder aipod.app
https://w2k.sh/phillipphoney6 w2k.sh
https://duanju.meiwang360.com/nikiberman6662 duanju.meiwang360.com
https://git.becks-web.de/pearlinekepert https://git.becks-web.de/
https://www.arabianmatrimony.com/@sherrizzs4369 www.arabianmatrimony.com
https://git.cydedu.com/margeneconklin https://git.cydedu.com/
https://datez.pro/@dannielledebav datez.pro
https://movieru.jp/portfolio/@aubrey18527154?page=about movieru.jp
http://git.jetplasma-oa.com/lurlenerosa373 git.jetplasma-oa.com
https://ophiuchus.wiki/juanasiede9198 https://ophiuchus.wiki/
https://code.openmobius.com:3001/carmellacayton https://code.openmobius.com/
https://git.deadpoo.net/erinstultz7369 https://git.deadpoo.net/
https://familyworld.io/@cherihooker99?page=about familyworld.io
https://badoo.camanchacapp.cl/@daybessie19560 https://badoo.camanchacapp.cl
https://profmustafa.com/@wadegrose68108?page=about profmustafa.com
https://qarisound.com/stefanl7151772 qarisound.com
https://git.lolpro11.me/billiegreenup4 git.lolpro11.me
https://www.adultgg.com/@tahliarevell51?page=about https://www.adultgg.com/
https://git.andy.lgbt/margeryscholl git.andy.lgbt
https://git.4lcap.com/thelmagrossman git.4lcap.com
https://gitea.abra.me/phillis44v9923 gitea.abra.me
http://geekhosting.company/elizbethzahn5 geekhosting.company
https://cameotv.cc/@leathanicholls?page=about https://cameotv.cc
https://xajhuang.com:3100/woodrowperson5 https://xajhuang.com:3100/woodrowperson5
https://www.buythetruth.org/mediaplayer/@irwinquinn4898?page=about www.buythetruth.org
https://git.repo.in.net/elijahgooch265 https://git.repo.in.net/elijahgooch265
https://postyourworld.com/@karmastoner782?page=about https://postyourworld.com/
https://likemochi.com/@gusetp95416950?page=about https://likemochi.com/@gusetp95416950?page=about
https://gitea.codedbycaleb.com/koreyhibbins92 https://gitea.codedbycaleb.com/koreyhibbins92
https://git.snowcloak-sync.com/camillaocasio git.snowcloak-sync.com
https://k0ki-dev.com/mickiw44344885 https://k0ki-dev.com/mickiw44344885
http://git.veilytech.com/u/elmogoins78953 git.veilytech.com
https://git.westeros.fr/orvilletoliver https://git.westeros.fr/orvilletoliver
https://datez.pro/@changshelley0 datez.pro
https://bluebirdmusic.in/@delbenavides21?page=about https://bluebirdmusic.in/@delbenavides21?page=about
http://www.factory18.cn/vandenehy6443 factory18.cn
https://git.traband.ovh/tonia99h125558 https://git.traband.ovh/tonia99h125558
https://git.unitsoft.io/jackinicolle3 git.unitsoft.io
https://gitea.cncfstack.com/czpashley09972 https://gitea.cncfstack.com/
https://git.jzxer.cn/estelle378249 git.jzxer.cn
https://git.barsisr.fr/felipearonson git.barsisr.fr
https://isugar-dating.com/@averynorthey68 https://isugar-dating.com/@averynorthey68
https://git.limework.net/rvmgordon5672 git.limework.net
https://git.werkraum-karlsruhe.org/tandyramsbotha https://git.werkraum-karlsruhe.org
https://gitea.dcqrr.top:83/leomaness0195 https://gitea.dcqrr.top
https://easyconnect.fun/@elizabetniles2 https://easyconnect.fun/@elizabetniles2
https://video.cheeft.com/@preciousgaithe?page=about video.cheeft.com
https://gosvid.com/@earllogsdon928?page=about gosvid.com
https://gitea.blubeacon.com/leiacapuano71 gitea.blubeacon.com
https://gitea.abra.me/rurjuliane2277 https://gitea.abra.me/rurjuliane2277
https://freshtube.net/@claudiaswint3?page=about freshtube.net
https://loveis.app/@jolenetimmerma loveis.app
https://gitea.svc.obaa.cloud/leonarden51090 gitea.svc.obaa.cloud
https://git.qingbs.com/deweywinters1 https://git.qingbs.com/deweywinters1
https://git.deadpoo.net/antonio68f025 git.deadpoo.net
http://git.baobaot.com/cdtkassandra32 git.baobaot.com
https://git.hundseth.com/karrifortune53 https://git.hundseth.com/karrifortune53
https://gitea.kdlsvps.top/aleciaschutt00 gitea.kdlsvps.top
https://sithcom.de/maplejasso1915 sithcom.de
https://gitea.marvinronk.com/donny746395043 gitea.marvinronk.com
https://gitea.xtometa.com/elisabethmckee gitea.xtometa.com
https://www.jr-it-services.de:3000/kassiefantl47 https://www.jr-it-services.de/
https://fyahtrak.com/yvettechau709 fyahtrak.com
https://music.growverse.net/erwinmlm18658 music.growverse.net
https://home.zhupei.me:3000/johnathanmulli https://home.zhupei.me:3000/johnathanmulli
https://git.getmind.cn/finlaynowell35 git.getmind.cn
https://dainiknews.com/@ccakatharina41?page=about dainiknews.com
http://spnewstv.com/@luciennemyles?page=about http://spnewstv.com
https://platform.giftedsoulsent.com/mitchellmays20 platform.giftedsoulsent.com
https://snaytube.com/@bradyk08554640?page=about snaytube.com
https://git.olyntec.com/buddywechsler git.olyntec.com
https://git.traband.ovh/pollybalcombe https://git.traband.ovh
https://git.bremauer.cc/shonaerickson https://git.bremauer.cc/shonaerickson
https://www.musicsound.ca/lakeishamayer https://www.musicsound.ca/
https://git.obo.cash/adelineramsden git.obo.cash
https://devkona.net/eulaliamargare https://devkona.net/
https://www.beyoncetube.com/@colefellows72?page=about https://www.beyoncetube.com/@colefellows72?page=about
https://ophiuchus.wiki/rebekahmcneely ophiuchus.wiki
https://itimez.com/@harveybrodzky5?page=about https://itimez.com/@harveybrodzky5?page=about
https://git.barsisr.fr/hectorcromwell git.barsisr.fr
https://matchmingle.fun/@lashawnda69771 matchmingle.fun
https://homeview.emmcoc.com.ng/@elishabastyan?page=about homeview.emmcoc.com.ng
http://git.zkyspace.top/roccoshetler86 git.zkyspace.top
http://xcfw.cn:13000/reginaldardill http://xcfw.cn
https://cash.com.tr/@blairbrigham6?page=about https://cash.com.tr/@blairbrigham6?page=about
https://fyahtrak.com/quinnrosenbalm https://fyahtrak.com/quinnrosenbalm
https://git.cydedu.com/angelcrum69249 git.cydedu.com
https://git.mdp.edu.ar/richelle170339 git.mdp.edu.ar
https://freevideocanal.com/@hildreddenny42?page=about freevideocanal.com
https://git.arachno.de/henryrayner794 git.arachno.de
https://git.dpark.io/ojkroxie84954 git.dpark.io
http://repo.fusi24.com:3000/colettezachary repo.fusi24.com
https://git.lakaweb.com/tylerstreeten git.lakaweb.com
https://gitiplay.com/@flossiecoolidg?page=about gitiplay.com
https://g.6tm.es/spradele781170 https://g.6tm.es
https://www.merlmerl.com/@antoineledger?page=about https://www.merlmerl.com
https://git.mdp.edu.ar/aracelyg163555 https://git.mdp.edu.ar/
https://fyahtrak.com/buddy018936562 fyahtrak.com
https://musixx.smart-und-nett.de/chelseaconnell musixx.smart-und-nett.de
https://git.tea-assets.com/jacelyndurack5 https://git.tea-assets.com
http://git.modelhub.org.cn:980/clarkbvs71841 git.modelhub.org.cn
https://inmessage.site/@hildegardestoc https://inmessage.site/
https://csmtube.exagopartners.com/@genevievebetti?page=about csmtube.exagopartners.com
https://www.ituac.com/lynell7246291 www.ituac.com
http://gitea.liaozhuangkeji.com/erinely7227980 http://gitea.liaozhuangkeji.com/
http://git.youkehulian.cn/anyafinlay5606 http://git.youkehulian.cn/anyafinlay5606
http://git.wanggaofeng.cn:3000/laurenvalazque git.wanggaofeng.cn
https://git.koppa.pro/raemowll456340 git.koppa.pro
https://git.erdei-dev.hu/eleanorewhitfe git.erdei-dev.hu
https://sheyiyuan.cn/tiffani6359736 sheyiyuan.cn
https://gogs.kakaranet.com/arlenvinson673 gogs.kakaranet.com
https://cutenite.com/@alexisburbidge https://cutenite.com/@alexisburbidge
https://myafritube.com/@dqbbianca3904?page=about myafritube.com
https://nas.zearon.com:2001/rogeliom936632 nas.zearon.com
https://gitea.irons.nz/dianlittle3330 gitea.irons.nz
https://jovita.com/aileenmcghee2 https://jovita.com/
https://cutenite.com/@alexisburbidge https://cutenite.com/@alexisburbidge
https://git.obo.cash/devinl35686720 https://git.obo.cash/
https://learninghub.fulljam.com/@sammyhilton025?page=about https://learninghub.fulljam.com/@sammyhilton025?page=about
http://gitea.wholelove.com.tw:3000/maurine3120320 http://gitea.wholelove.com.tw/
https://www.onlywam.tv/@lincolnong687?page=about https://www.onlywam.tv/
http://git.wanggaofeng.cn:3000/skyedoolan6492 http://git.wanggaofeng.cn/
https://git.unicom.studio/ramiro08q65302 git.unicom.studio
http://tools.refinecolor.com/imogen07m2435 http://tools.refinecolor.com
https://gitea.my-intrudair.com/rory9362928518 gitea.my-intrudair.com
https://git.rokiy.com/benniebassett5 git.rokiy.com
https://movieru.jp/portfolio/@rossmcgowen81?page=about movieru.jp
https://git.ecq.jp/saraboucaut456 git.ecq.jp
https://gitea.mpc-web.jp/aracelyshapiro gitea.mpc-web.jp
http://git.wanggaofeng.cn:3000/zacargueta7685 git.wanggaofeng.cn
https://git.mklpiening.de/violawhitton08 git.mklpiening.de
https://2ubii.com/@maritapdx5884?page=about 2ubii.com
https://www.sugarmummyx.com/@noewoo8926379?page=about www.sugarmummyx.com
https://deltasongs.com/valenciadaluz4 https://deltasongs.com/valenciadaluz4
https://www.fuzongyao.cn/alfonsokeith9 fuzongyao.cn
https://gitea.ysme.top/fionahiginboth gitea.ysme.top
https://gitea.kdlsvps.top/orenhawks01561 gitea.kdlsvps.top
https://gitea.quiztimes.nl/wilhelminamcca https://gitea.quiztimes.nl/wilhelminamcca
https://gitea.potatox.net/andreazqq21502 https://gitea.potatox.net
http://farsinot.ir:3000/kristenmacfarl http://farsinot.ir:3000/kristenmacfarl
http://dibodating.com/@dannynabors344 dibodating.com
http://sheyiyuan.cn:3000/antoniohurwitz http://sheyiyuan.cn:3000/antoniohurwitz
https://git.unitsoft.io/connieclaborn0 https://git.unitsoft.io/
https://nuhweh.com/mahalialease6 nuhweh.com
https://git.tordarus.net/jamesbequette git.tordarus.net
http://dibodating.com/@dannynabors344 http://dibodating.com/@dannynabors344
https://datemyfamily.tv/@anneliesedial datemyfamily.tv
https://schokigeschmack.de/jurgendewees55 schokigeschmack.de
https://gitea.jasonstolle.com/estelashillito gitea.jasonstolle.com
https://vrstube.xyz/@sven5605004874?page=about https://vrstube.xyz
https://www.k0ki-dev.de/karinewhittle www.k0ki-dev.de
http://git.wanggaofeng.cn:3000/erinbiscoe1268 git.wanggaofeng.cn
https://computerhalle.eu/rodgerbackhous computerhalle.eu
https://rapid.tube/@leandrogormly3?page=about https://rapid.tube
https://git.werkraum-karlsruhe.org/suzannaerk5535 git.werkraum-karlsruhe.org
https://datilimo.com/@aleciavaux3309?page=about datilimo.com
https://meetdatingpartners.com/@troydorman6207 https://meetdatingpartners.com
http://git.zkyspace.top/lindseyling52 git.zkyspace.top
http://tools.refinecolor.com/dorotheajxu323 tools.refinecolor.com
http://git.jishutao.com/rochell82y9559 http://git.jishutao.com/rochell82y9559
https://git.unitsoft.io/koryellsworth https://git.unitsoft.io/
https://sound.gatzone.com/kariwithrow479 sound.gatzone.com
https://familyworld.io/@murraydruitt1?page=about https://familyworld.io/@murraydruitt1?page=about
https://w2k.sh/malloryguilfoy https://w2k.sh
https://git.daoyoucloud.com/maikmungo47135 git.daoyoucloud.com
http://git.7doc.com.cn/linorichart488 http://git.7doc.com.cn/linorichart488
https://www.shwemusic.com/faustinolozano www.shwemusic.com
https://git.cloud.leonclassroom.com/lorenaplate78 https://git.cloud.leonclassroom.com
https://git.autotion.net/lidao37270476 git.autotion.net
https://thefusionflix.com/@rileypenrod43?page=about thefusionflix.com
https://lesla.com/@janellepinckne lesla.com
https://git.repo.in.net/kishagoossens2 git.repo.in.net
https://git.cloud.leonclassroom.com/rory0406342898 git.cloud.leonclassroom.com
https://computerhalle.eu/dana05k925600 computerhalle.eu
https://www.fastmarry.com/@janet272130352 www.fastmarry.com
https://meetdatingpartners.com/@leolatotten131 https://meetdatingpartners.com/@leolatotten131
https://my70size.com/@johnnypouncy94?page=about my70size.com
https://newborhooddates.com/@evabartlett536 newborhooddates.com
https://aiviu.app/@lupehdq4452507?page=about aiviu.app
https://gitea.xtometa.com/augustinakalb https://gitea.xtometa.com
https://webba.cz/@thaddeusmccubb?page=about webba.cz
https://git.tordarus.net/jamesbequette git.tordarus.net
https://git.hexaquo.at/lorihaveman517 git.hexaquo.at
https://repo.divisilabs.com/kristaullathor repo.divisilabs.com
https://git.emanuelemiani.it/marion91x4538 https://git.emanuelemiani.it/marion91x4538
http://dev-gitlab.dev.sww.com.cn/lizettebobb78 http://dev-gitlab.dev.sww.com.cn/
https://soundcashmusic.com/islabader1812 soundcashmusic.com
https://blackvision.co.uk/@louisaredding6?page=about blackvision.co.uk
https://git.tablet.sh/bkljody844124 git.tablet.sh
https://git.atomos.io/gerardtimbery0 git.atomos.io
https://rapid.tube/@dirkbecker562?page=about rapid.tube
https://gitea.morawietz.dev/boyceburks9412 gitea.morawietz.dev
https://git.bayview.top/nanq8448076274 git.bayview.top
https://music.michaelmknight.com/josettegaines6 https://music.michaelmknight.com/josettegaines6
https://git.jbangit.com/ronnybolliger8 git.jbangit.com
https://isugar-dating.com/@andytje669759 isugar-dating.com
https://quickdate.thenexivo.com/@malcolm1962092 https://quickdate.thenexivo.com
http://git.liubeiting.cn:8000/kiaclark64912 http://git.liubeiting.cn
https://kannadatube.in/@marcyewers2459?page=about https://kannadatube.in/
http://dibodating.com/@austinb6685255 http://dibodating.com/@austinb6685255
https://lius.familyds.org:3000/selmatha102122 lius.familyds.org
https://git.dpark.io/brianfusco048 https://git.dpark.io/
https://askmilton.tv/@shadventura200?page=about askmilton.tv
https://thefusionflix.com/@lowellroot9232?page=about https://thefusionflix.com
http://gitea.liaozhuangkeji.com/russellplate90 gitea.liaozhuangkeji.com
https://gitea.mecro.ee/genieblossevil gitea.mecro.ee
https://stukguitar.com/@frederickfrias?page=about stukguitar.com
https://bfreetv.com/@christyhughey3?page=about bfreetv.com
http://git.2weisou.com/bertiesee28186 http://git.2weisou.com/
https://git.unitsoft.io/jackinicolle3 https://git.unitsoft.io/jackinicolle3
https://git.ghostpacket.org/angelitai11274 git.ghostpacket.org
http://www.huastech.com.cn:81/geraldo7676107 http://www.huastech.com.cn
https://clikview.com/@johnson02o7550?page=about clikview.com
https://git.cnml.de/ajaoxo16448042 https://git.cnml.de/ajaoxo16448042
https://git.louislabs.com/deidremcculloc git.louislabs.com
http://www.factory18.cn/meredithvillar www.factory18.cn
https://nas.zearon.com:2001/rogeliom936632 https://nas.zearon.com
https://git.louislabs.com/antoinettesten git.louislabs.com
https://aitnas.myasustor.com/sandyteresa870 aitnas.myasustor.com
https://git.ecq.jp/agnes55a825362 https://git.ecq.jp/agnes55a825362
http://dev.baidubaoche.com/lynellhumphrey dev.baidubaoche.com
https://git.sudo-fhir.au/katricefinckh git.sudo-fhir.au
https://git.galaxylabs.ca/tamnewell49725 git.galaxylabs.ca
https://git.palagov.tv/bmqlindsay5032 https://git.palagov.tv/bmqlindsay5032
https://cash.com.tr/@fosterviner613?page=about https://cash.com.tr/
https://grafana.jasonstolle.com/earnestblackwe grafana.jasonstolle.com
https://gogolive.biz/@mikefredrickse?page=about gogolive.biz
https://camtalking.com/@frederickheydo camtalking.com
https://aipod.app/tinacaesar6232 aipod.app
https://git.memosnag.com/taylah37i64830 https://git.memosnag.com/taylah37i64830
https://ljs.fun:19000/junkomcalexand ljs.fun
http://dibodating.com/@wilfredq15224 http://dibodating.com/@wilfredq15224
https://beetube.gpas.co/@cheriesnider32?page=about https://beetube.gpas.co/@cheriesnider32?page=about
https://git.sgap.uk/nate8587663782 git.sgap.uk
https://mmctube.com/@roxanawmr71634?page=about mmctube.com
https://stevewpalmer.uk/shoshanaking92 https://stevewpalmer.uk
http://git.fbonazzi.it/alfonzoalba684 http://git.fbonazzi.it/
https://kaymanuell.com/@enrique02r5467?page=about https://kaymanuell.com/@enrique02r5467?page=about
https://git.winscloud.net/jaxonheadley01 https://git.winscloud.net/jaxonheadley01
https://www.meetgr.com/@ethel72e059905 https://www.meetgr.com
https://git.kirasparkle.de/bzdcarmon95149 https://git.kirasparkle.de/bzdcarmon95149
https://g.6tm.es/luciosteger061 https://g.6tm.es/
http://git.ibossay.com:3000/tammaraprichar http://git.ibossay.com
http://bot.61ns.com:3000/mariecaperton0 http://bot.61ns.com/
https://theindievibes.com/deandrebarnard theindievibes.com
https://meetdatingpartners.com/@aubrey65443919 meetdatingpartners.com
https://code.openmobius.com:3001/jeanne30t94349 https://code.openmobius.com:3001/jeanne30t94349
https://git.bremauer.cc/gabrielleewan https://git.bremauer.cc/gabrielleewan
https://gitea.codedbycaleb.com/koreyhibbins92 gitea.codedbycaleb.com
http://apps.iwmbd.com/aliceglynn9649 apps.iwmbd.com
https://soundcashmusic.com/andy97e9240749 https://soundcashmusic.com
https://git.sleepingforest.co.uk/refugio88v695 git.sleepingforest.co.uk
https://git.agusandelnorte.gov.ph/halleyclifford https://git.agusandelnorte.gov.ph
https://git.repo.in.net/shaylaisabel14 https://git.repo.in.net
https://play.eccentric.etc.br/@lamartibbs1661?page=about https://play.eccentric.etc.br/
https://naijasingles.net/@romanfosbery74 naijasingles.net
https://gitea.b54.co/trista57578626 https://gitea.b54.co/
https://gitea.ontoast.uk/benjaminoreill https://gitea.ontoast.uk/benjaminoreill
https://gitea.noname-studios.es/christianeabra gitea.noname-studios.es
https://chinami.com/@casimiradundal?page=about chinami.com
http://dev-gitlab.dev.sww.com.cn/lizettebobb78 dev-gitlab.dev.sww.com.cn
https://www.bongmedia.tv/@franklynkippax?page=about https://www.bongmedia.tv
https://blackvision.co.uk/@bobbieoshea631?page=about https://blackvision.co.uk/@bobbieoshea631?page=about
http://git.modelhub.org.cn:980/quentin9676017 git.modelhub.org.cn
http://gitea.shundaonetwork.com/elvincampos58 gitea.shundaonetwork.com
https://dating.hyesearch.com/@percyschiffman dating.hyesearch.com
http://git.wanggaofeng.cn:3000/beauhastings61 git.wanggaofeng.cn
https://www.broutube.com/@jannettepxd192?page=about www.broutube.com
https://qarisound.com/dmycathy883435 qarisound.com
http://www.mindepoch.com:9092/kandydelacruz www.mindepoch.com
https://git.erdei-dev.hu/angelostanfill https://git.erdei-dev.hu/angelostanfill
https://videos.awaregift.com/@bernicescarbro?page=about https://videos.awaregift.com/@bernicescarbro?page=about
http://git.fbonazzi.it/deandremarou78 git.fbonazzi.it
https://www.chenisgod.com:3096/emilylapham368 www.chenisgod.com
http://git.liubeiting.cn:8000/tamela09m3199 git.liubeiting.cn
https://great-worker.com/dolliehoeft57 great-worker.com
https://katibemaraty.com/@carltoncarnaha?page=about https://katibemaraty.com/@carltoncarnaha?page=about
https://git.erdei-dev.hu/angelostanfill git.erdei-dev.hu
http://repo.bpo.technology/tanishamorshea repo.bpo.technology
https://actv.1tv.hk/@juliethopkins7?page=about actv.1tv.hk
https://gitea.morawietz.dev/cyruscarreiro gitea.morawietz.dev
https://datebaku.com/@charliebeasley datebaku.com
https://git.unpas.dev/ryanlade148202 git.unpas.dev
https://git.olyntec.com/haley03i387063 git.olyntec.com
https://katambe.com/@glindanumbers5 katambe.com
https://grabtv.xyz/@jacksonvasey1?page=about https://grabtv.xyz/
https://gitea.my-intrudair.com/nateblanco3635 https://gitea.my-intrudair.com/
https://git.xemo-net.de/kermitrku66822 https://git.xemo-net.de
https://meetdatingpartners.com/@leolatotten131 meetdatingpartners.com
https://git.lokalix.de/jeanna42h3497 git.lokalix.de
https://matchmingle.fun/@mitchony119738 matchmingle.fun
http://dengle.cc:3000/wilhemina31862 dengle.cc
https://gitlab.rails365.net/gemmadyn227443 gitlab.rails365.net
https://datilimo.com/@aleciavaux3309?page=about https://datilimo.com/@aleciavaux3309?page=about
https://nelgit.nelpi.co.uk/ismaeldecicco1 https://nelgit.nelpi.co.uk/ismaeldecicco1
https://circassianweb.com/video/@jamierosenberg?page=about circassianweb.com
https://git.sleepingforest.co.uk/gabrielaleroy https://git.sleepingforest.co.uk
http://youplay.az-solutions.pk//@carmelad951681?page=about youplay.az-solutions.pk
http://git.fbonazzi.it/valenciastoate git.fbonazzi.it
https://goeed.com/@giseleshores91?page=about https://goeed.com/@giseleshores91?page=about
https://digitalafterlife.org/@florencia18883?page=about digitalafterlife.org
https://git.gupaoedu.cn/eldenholiday24 git.gupaoedu.cn
https://yaseen.tv/@anguscabrera3?page=about yaseen.tv
https://gitea.svc.obaa.cloud/eliclarke97900 gitea.svc.obaa.cloud
http://repo.bpo.technology/jonnietla02616 http://repo.bpo.technology/
https://git.dpark.io/brianfusco048 git.dpark.io
https://actv.1tv.hk/@cesar97a62419?page=about https://actv.1tv.hk
https://thewerffreport.com/@quincy3649884?page=about thewerffreport.com
http://guishenking.cloud:3000/tarapink539680 guishenking.cloud
https://gitea.sguba.de/edmundov41098 gitea.sguba.de
https://www.oddmate.com/@gavinnyholm687 https://www.oddmate.com
https://git.caolongle.com/houstonbranch git.caolongle.com
https://gitea.morawietz.dev/cyruscarreiro gitea.morawietz.dev
https://sound.gatzone.com/clintonjoyner sound.gatzone.com
https://platform.giftedsoulsent.com/derrickhoff351 https://platform.giftedsoulsent.com
https://git.obo.cash/sherlynaddis0 git.obo.cash
http://saromusic.ir/leookeeffe6376 saromusic.ir
https://gitea.rodaw.net/mariloualberts gitea.rodaw.net
https://silatdating.com/@pamalamariano4 silatdating.com
https://i.megapollos.com/@twrtabitha789?page=about i.megapollos.com
https://gitea.coderpath.com/deanbuss422879 https://gitea.coderpath.com/
https://syq.im:2025/rafaela49o451 https://syq.im:2025/rafaela49o451
https://thescouter.co.uk/@tcdjorja82201?page=about thescouter.co.uk
https://lensez.info/danelledame509 lensez.info
https://quickplay.pro/lisamcgruder70 https://quickplay.pro/lisamcgruder70
https://forge.coreymclark.com/jennifershufel https://forge.coreymclark.com/
https://gitea.belanjaparts.com/vickeyinman322 https://gitea.belanjaparts.com/vickeyinman322
https://tubemone.com/@juliannnobbs91?page=about https://tubemone.com
https://gitlab.rails365.net/latiahazon991 gitlab.rails365.net
https://git.lunax.dev/sharronfkv5320 git.lunax.dev
http://git.edazone.cn/kathiwitzel62 git.edazone.cn
https://sithcom.de/vernotoole790 https://sithcom.de
https://gitea.kdlsvps.top/lorenzomcknigh gitea.kdlsvps.top
https://play.ayooka.com/@julia65i34360?page=about play.ayooka.com
https://superocho.org/@antonycintron6?page=about https://superocho.org/@antonycintron6?page=about
http://rm.runfox.com/gitlab/leopoldodalley http://rm.runfox.com
https://fyahtrak.com/quinnrosenbalm fyahtrak.com
https://badoo.camanchacapp.cl/@letarodd061560 https://badoo.camanchacapp.cl
https://nildigitalco.com/@jeffersonbrodn?page=about https://nildigitalco.com
https://git.lakaweb.com/tylerstreeten https://git.lakaweb.com/tylerstreeten
https://wiki.idealirc.org/rockyetheridge https://wiki.idealirc.org/rockyetheridge
http://www.huastech.com.cn:81/krishickman225 http://www.huastech.com.cn/
https://git.ghostpacket.org/chelseyfdm2849 https://git.ghostpacket.org/
https://daterondetjolie.fr/@laurenkiddle8 https://daterondetjolie.fr/
https://git.haowuan.top/roccom47789715 https://git.haowuan.top/roccom47789715
https://gitea.coderpath.com/homerjames9130 gitea.coderpath.com
https://crossy.video/@aldab40954848?page=about https://crossy.video/
https://zm.aosenhw.com/@christoperoaks zm.aosenhw.com
https://git.scene.to/andreasbyars54 git.scene.to
https://sheyiyuan.cn/jonnielima1009 https://sheyiyuan.cn
http://www.huastech.com.cn:81/krishickman225 http://www.huastech.com.cn/
https://cutenite.com/@alexisburbidge cutenite.com
https://dhivideo.com/@alliepantoja8?page=about https://dhivideo.com/@alliepantoja8?page=about
https://kaymanuell.com/@lizziehardman?page=about kaymanuell.com
http://gitea.liaozhuangkeji.com/cleostreet4969 gitea.liaozhuangkeji.com
https://platform.giftedsoulsent.com/danielleyia70 https://platform.giftedsoulsent.com/
https://git.koppa.pro/rogerrosanove https://git.koppa.pro/rogerrosanove
https://www.fastmarry.com/@estelaz4558011 https://www.fastmarry.com/
https://git.hanckh.top/carolynralston https://git.hanckh.top/carolynralston
https://git.rokiy.com/kristopherharo https://git.rokiy.com
https://gitea.johannes-hegele.de/tamelaseabrook gitea.johannes-hegele.de
https://datingmywish.com/@abbeytroup561 https://datingmywish.com/
https://www.enginx.dev/xdwalina979694 www.enginx.dev
http://test-www.writebug.com:3000/gscgloria9870 test-www.writebug.com
https://isugar-dating.com/@finlayoflahert https://isugar-dating.com/
https://gitea.my-intrudair.com/nateblanco3635 gitea.my-intrudair.com
http://migaplus.cn:7020/doloresvenable http://migaplus.cn:7020/doloresvenable
https://soundcashmusic.com/andy97e9240749 https://soundcashmusic.com
https://vila.go.ro/genniekeener1 https://vila.go.ro/
https://www.3coup.com/@margaritaduby0?page=about www.3coup.com
https://www.fastmarry.com/@janet272130352 fastmarry.com
https://zm.aosenhw.com/@christoperoaks zm.aosenhw.com
http://git.hjd999.com.cn/perrysamuels76 git.hjd999.com.cn
https://git.el-paco.com/esther49167716 git.el-paco.com
https://mxtube.mimeld.com/@kassandramcgui?page=about https://mxtube.mimeld.com/@kassandramcgui?page=about
https://git.z1.mk/anneliesecartl git.z1.mk
http://wangchongwu.vicp.fun:3333/dessiehager720 http://wangchongwu.vicp.fun
https://2ubii.com/@essiekennion77?page=about 2ubii.com
https://git.hexaquo.at/luciay49449465 git.hexaquo.at
https://fyahtrak.com/oliverbroadus3 fyahtrak.com
https://qimley.com/@annmarie87h057 qimley.com
https://freevideocanal.com/@rosalindaoconn?page=about https://freevideocanal.com/
https://gitea.cncfstack.com/alexandrapelen https://gitea.cncfstack.com/alexandrapelen
https://gitea.cybs.io/eleanoreglenni gitea.cybs.io
https://gitea.noname-studios.es/danniemcmillia https://gitea.noname-studios.es/danniemcmillia
https://git.4lcap.com/soila40n922566 git.4lcap.com
https://deltasongs.com/valenciadaluz4 deltasongs.com
https://git.limework.net/rvmgordon5672 https://git.limework.net/rvmgordon5672
https://gitea.xtometa.com/kentsheridan05 https://gitea.xtometa.com/kentsheridan05
https://git.obo.cash/elsacarson7960 https://git.obo.cash
https://gitea.abra.me/cindyfoskett67 gitea.abra.me
https://git.arachno.de/wendylipscombe git.arachno.de
https://git.hexaquo.at/melvaz98399666 git.hexaquo.at
https://hipstrumentals.net/mitchellboyce6 hipstrumentals.net
https://gitea.kdlsvps.top/orenhawks01561 gitea.kdlsvps.top
https://play.future.al/@darcischuler2?page=about play.future.al
https://www.kornerspot.com/@sherlenerice5 www.kornerspot.com
https://gitea.noname-studios.es/xqzdamion85645 gitea.noname-studios.es
https://stukguitar.com/@florencesarane?page=about https://stukguitar.com/@florencesarane?page=about
https://git.cnml.de/yygterrance002 https://git.cnml.de/yygterrance002
https://gitea.my-intrudair.com/rory9362928518 gitea.my-intrudair.com
https://dainiknews.com/@staciebibi0522?page=about dainiknews.com
https://nemesisgit.com/quentin5332789 https://nemesisgit.com/quentin5332789
https://meetdatingpartners.com/@sharroncasiano meetdatingpartners.com
https://git.saidomar.fr/sherrylespinoz git.saidomar.fr
http://repo.bpo.technology/tanishamorshea http://repo.bpo.technology/tanishamorshea
https://gitea.b54.co/solmoulton9360 https://gitea.b54.co/solmoulton9360
https://theindietube.com/@dallasfavela4?page=about theindietube.com
https://repo.apps.odatahub.net/gilbertomoberg https://repo.apps.odatahub.net/gilbertomoberg
https://git.hanckh.top/federicocable8 git.hanckh.top
https://date.ainfinity.com.br/@sibylmagrath77 date.ainfinity.com.br
http://spnewstv.com/@roxannapaget30?page=about spnewstv.com
https://git.cymnb.com/abrahamsanto7 https://git.cymnb.com/abrahamsanto7
http://xny.yj-3d.com:3000/taylorcoley929 xny.yj-3d.com
https://git.rec4box.com/reginalevering git.rec4box.com
https://maru.bnkode.com/@jorgmedland675 https://maru.bnkode.com/@jorgmedland675
https://repo.apps.odatahub.net/gilbertomoberg https://repo.apps.odatahub.net
https://aitnas.myasustor.com/youngholloman aitnas.myasustor.com
https://git.kirasparkle.de/cornelljarnagi https://git.kirasparkle.de/cornelljarnagi
https://www.musicsound.ca/harrispsu68102 www.musicsound.ca
https://gitea.dcqrr.top:83/chanelgreville https://gitea.dcqrr.top
https://playxtream.com/@christopherynq?page=about playxtream.com
https://git.arachno.de/richelleebner1 https://git.arachno.de/richelleebner1
https://git.qingbs.com/genevievecradd git.qingbs.com
https://gitea.chloefontenot.org/sandymerrifiel gitea.chloefontenot.org
https://gitlab.rails365.net/glorybradbury3 https://gitlab.rails365.net/glorybradbury3
https://git.ezmuze.co.uk/val47799811754 https://git.ezmuze.co.uk/val47799811754
https://ceedmusic.com/jacquescarrion ceedmusic.com
https://www.herzog-it.de/fredricdaugher www.herzog-it.de
http://repo.bpo.technology/tanishamorshea repo.bpo.technology
https://git.lunax.dev/sharronfkv5320 git.lunax.dev
https://git.nightime.org/rebbecagreenwe https://git.nightime.org
http://git.7doc.com.cn/willianneeley git.7doc.com.cn
https://beatsong.app/mattie59384484 https://beatsong.app/mattie59384484
https://seychelleslove.com/@mandyandes3190 seychelleslove.com
https://git.bloade.com/forest13275146 https://git.bloade.com/forest13275146
http://git.7doc.com.cn/fredricksumsum http://git.7doc.com.cn/
http://gitea.shundaonetwork.com/elvincampos58 gitea.shundaonetwork.com
https://git.westeros.fr/valeriebills93 git.westeros.fr
https://cutenite.com/@pearlenepascal cutenite.com
http://gitea.frp.linyanli.cn/amberwegener3 gitea.frp.linyanli.cn
https://git.penwing.org/rhodaplume3125 git.penwing.org
https://esvoe.video/@lorettatardent?page=about https://esvoe.video/@lorettatardent?page=about
https://flixwood.com/@charlievenuti?page=about https://flixwood.com/@charlievenuti?page=about
https://git.daoyoucloud.com/milagrosnook6 https://git.daoyoucloud.com
https://gogolive.biz/@raphaelhirst91?page=about https://gogolive.biz/@raphaelhirst91?page=about
https://git.olyntec.com/dylantrumble2 git.olyntec.com
https://hgngit.ipdz.me/ezekielraymond hgngit.ipdz.me
https://gitea.marvinronk.com/donny746395043 https://gitea.marvinronk.com/donny746395043
https://ngoma.app/bonnieboggs757 https://ngoma.app
https://laviesound.com/shaynekibby068 laviesound.com
https://matchmadeinasia.com/@ernestinemutch matchmadeinasia.com
https://thewerffreport.com/@josettepie211?page=about thewerffreport.com
https://git.nusaerp.com/charlesturney7 https://git.nusaerp.com/
http://git.pushecommerce.com/margeryreddick git.pushecommerce.com
https://www.enginx.dev/margenedeboos0 www.enginx.dev
https://twoheartsagency.com/@abxflorencia00 https://twoheartsagency.com/@abxflorencia00
https://selfloveaffirmations.net/@richderry99202 selfloveaffirmations.net
https://yooverse.com/@clairereddall yooverse.com
https://sithcom.de/bereniceshade https://sithcom.de/bereniceshade
https://git2.huai-yun.com/debbragillilan https://git2.huai-yun.com/debbragillilan
https://www.enginx.dev/margenedeboos0 enginx.dev
https://nijavibes.com/pqdroscoe75475 https://nijavibes.com/pqdroscoe75475
http://yin520.cn:3000/jerrimichaud9 http://yin520.cn:3000/jerrimichaud9
http://git.7doc.com.cn/fredricksumsum http://git.7doc.com.cn/fredricksumsum
https://home.zhupei.me:3000/janettendg5349 https://home.zhupei.me/
https://gitea.synapsetec.cn/htengan6387194 https://gitea.synapsetec.cn/htengan6387194
https://git.srblerp.com/jesspercy38842 git.srblerp.com
https://ngoma.app/quincy67c14955 https://ngoma.app/quincy67c14955
https://git.mopsovi.cloud/timothy34z4577 git.mopsovi.cloud
https://git.clarue.net/tanesharason95 git.clarue.net
https://gitea.offends.cn/pasqualebecker gitea.offends.cn
https://geniusactionblueprint.com/@jannettef1482?page=about https://geniusactionblueprint.com/@jannettef1482?page=about
https://datez.pro/@shanibeazley32 datez.pro
https://sithcom.de/danielaflorey2 https://sithcom.de/danielaflorey2
https://i.megapollos.com/@deonhiggin1249?page=about https://i.megapollos.com/
http://share.pkbigdata.com/princemackness share.pkbigdata.com
https://git.qingbs.com/florvogel21807 https://git.qingbs.com
https://vrstube.xyz/@faemai8471577?page=about https://vrstube.xyz
https://gitea.gimmin.com/chelseywilfred https://gitea.gimmin.com/chelseywilfred
https://git.rbsx.de/elidategg5751 git.rbsx.de
https://sounddeep.blacktube.in/roxanamacmahon sounddeep.blacktube.in
https://viraltry.com/@ettabruns20722?page=about viraltry.com
https://cameotv.cc/@callieellis500?page=about https://cameotv.cc
https://datez.pro/@stefanieworth datez.pro
https://sound.floofbite.com/jefff607156182 sound.floofbite.com
https://bfreetv.com/@dianpickles741?page=about https://bfreetv.com
https://bantooplay.com/@elvismouton982?page=about bantooplay.com
https://git.dadunode.com/ryanminter1866 git.dadunode.com
https://gt.clarifylife.net/stlfredrick450 https://gt.clarifylife.net/stlfredrick450
https://git.dpark.io/sterlingfoley https://git.dpark.io/
https://tokemonkey.com/read-blog/212600_anabolic-steroids-uses-side-effects-and-alternatives.html https://tokemonkey.com
https://islamyaat.com/@iveyv183578829?page=about islamyaat.com
https://echbar.online/dewitttyson212 echbar.online
https://www.italia24.tv/tube/@theresanorthco?page=about www.italia24.tv
https://git2.huai-yun.com/alvin10t081240 https://git2.huai-yun.com/
https://gitea.xtometa.com/milesnesbit99 https://gitea.xtometa.com/milesnesbit99
https://quickdate.thenexivo.com/@cassie74481587 quickdate.thenexivo.com
https://gitea.alaindee.net/palmaboelke861 gitea.alaindee.net
https://git.erdei-dev.hu/utalaroche938 git.erdei-dev.hu
https://allyoutubes.com/@dellhaynie6509?page=about allyoutubes.com
https://git.influxfin.com/fideliaeastin7 git.influxfin.com
https://lesla.com/@giayarbro80456 https://lesla.com/@giayarbro80456
https://gitea.ysme.top/patriciacottma https://gitea.ysme.top/patriciacottma
https://gitea.johannes-hegele.de/magarete271633 gitea.johannes-hegele.de
https://git.ism-dev.net/glennaprieur7 git.ism-dev.net
https://tunelifystream.com/orenvarney5213 tunelifystream.com
https://gitea.dusays.com/marthamusgrove https://gitea.dusays.com/marthamusgrove
http://dev.baidubaoche.com/jacquettagantt http://dev.baidubaoche.com/jacquettagantt
https://quenly.com/@ashlymacandie5 quenly.com
https://www.besolife.com/@clydepelzer59 www.besolife.com
https://code.ioms.cc/juliusreddy752 code.ioms.cc
https://www.appleradish.org/julihomer4662 www.appleradish.org
https://git.tbaer.de/kentonhoare401 git.tbaer.de
https://gogolive.biz/@jorgebridgefor?page=about https://gogolive.biz
https://www.zapztv.com/@jodimaclanacha?page=about https://www.zapztv.com/
https://hbcustream.com/@uajcecelia535?page=about hbcustream.com
https://artbeninshow.afiganmey.com/todlongford809 artbeninshow.afiganmey.com
https://git.andy.lgbt/ellienoble1973 git.andy.lgbt
https://git.unglab.com/kexjess327705 https://git.unglab.com
https://code.lefou.at/kiraschubert7 code.lefou.at
http://xny.yj-3d.com:3000/taylorcoley929 xny.yj-3d.com
https://git.bremauer.cc/mckinleysincla https://git.bremauer.cc
https://openedu.com/@stormyn0113848?page=about openedu.com
https://git.cukak.com/delilaswartwoo git.cukak.com
https://git.lolpro11.me/arethawilhite git.lolpro11.me
https://financevideosmedia.com/@deoncorby80660?page=about financevideosmedia.com
https://phoebe.roshka.com/gitlab/priscillaschme https://phoebe.roshka.com/
https://devops.rs2i.fr/darrylstagg930 https://devops.rs2i.fr/darrylstagg930
https://openedu.com/@stormyn0113848?page=about openedu.com
https://git.nusaerp.com/arlenendc75341 git.nusaerp.com
https://pleroma.cnuc.nu/clairaustral47 pleroma.cnuc.nu
http://git.jetplasma-oa.com/halleysteed050 git.jetplasma-oa.com
https://git.smartenergi.org/elbafzo9800628 https://git.smartenergi.org/
https://pilowtalks.com/@jorjameiners86 pilowtalks.com
https://nuhweh.com/amber44q841895 nuhweh.com
https://gitea.kdlsvps.top/lorenzomcknigh gitea.kdlsvps.top
https://gogs.kakaranet.com/adrianelkin411 gogs.kakaranet.com
https://git.lmskaran.com/maggieburden0 git.lmskaran.com
https://datez.pro/@dexterchoi8489 datez.pro
https://git.dihe.moe/nellieramaciot https://git.dihe.moe/nellieramaciot
https://silatdating.com/@pamalamariano4 https://silatdating.com/@pamalamariano4
https://www.chembans.com/@brockrawlings www.chembans.com
https://www.telugustatusvideo.com/@laneglasfurd8?page=about https://www.telugustatusvideo.com/
https://geniusactionblueprint.com/@jannettef1482?page=about geniusactionblueprint.com
https://www.adultgg.com/@anitranewquist?page=about https://www.adultgg.com/
https://onlyaimovies.com/@christi90x3526?page=about https://onlyaimovies.com/
https://music.michaelmknight.com/josettegaines6 https://music.michaelmknight.com/josettegaines6
https://1coner.com/@elanaclaude841 https://1coner.com/@elanaclaude841
https://qimley.com/@jackietrugerna qimley.com
https://gitea.belanjaparts.com/solomonryland https://gitea.belanjaparts.com/solomonryland
https://git.dihe.moe/nellieramaciot git.dihe.moe
https://tintinger.org/olahuntington3 tintinger.org
https://katibemaraty.com/@lonny19n147217?page=about https://katibemaraty.com
https://git.pasarex.com/stantonbancks git.pasarex.com
https://git.noxxxx.com/letaj87931003 git.noxxxx.com
https://www.singuratate.ro/@lorrieiok21240 singuratate.ro
https://git.sgap.uk/pvecora0832064 git.sgap.uk
https://play.future.al/@maxineandre863?page=about https://play.future.al
https://www.simpra.org:3000/lupitalajoie25 www.simpra.org
https://www.streemie.com/@leviheaton4193?page=about https://www.streemie.com/@leviheaton4193?page=about
http://gitea.liaozhuangkeji.com/aaronemmons888 http://gitea.liaozhuangkeji.com/aaronemmons888
http://gitea.yunshanghub.com:8081/domingohmelnit http://gitea.yunshanghub.com:8081/domingohmelnit
https://git.erdei-dev.hu/allisonflora95 https://git.erdei-dev.hu
https://git.cloud.leonclassroom.com/juliusz2614825 git.cloud.leonclassroom.com
http://gitea.liaozhuangkeji.com/estellefoi4288 gitea.liaozhuangkeji.com
https://git.emanuelemiani.it/maddisonfranke https://git.emanuelemiani.it/maddisonfranke
https://git.migoooo.com/emilylel836381 https://git.migoooo.com/
https://adsandclips.com/@jadastilwell85?page=about https://adsandclips.com/
https://nelgit.nelpi.co.uk/bdgjanessa3072 https://nelgit.nelpi.co.uk/bdgjanessa3072
https://git.noxxxx.com/angelinatorren https://git.noxxxx.com/
https://git.noxxxx.com/audreykennerle git.noxxxx.com
https://quickdate.thenexivo.com/@kandymayers513 quickdate.thenexivo.com
https://deepsound.thenexivo.com/grettagayman6 deepsound.thenexivo.com
https://git.jzxer.cn/thaliaranford https://git.jzxer.cn/thaliaranford
http://apps.iwmbd.com/justine86z3661 http://apps.iwmbd.com/justine86z3661
https://git.karma-riuk.com/lolahollway302 git.karma-riuk.com
https://git.scene.to/malissashick93 git.scene.to
https://gitea.micro-stack.org/christelwangan gitea.micro-stack.org
http://malingshu.site:6010/concettacarrig http://malingshu.site
https://www.ituac.com/osvaldolundstr https://www.ituac.com/osvaldolundstr
https://gitea.kdlsvps.top/linoveitch2437 gitea.kdlsvps.top
https://gitimpo.liara.run/monikavansickl gitimpo.liara.run
https://gogs.soyootech.com/wwxpenney90629 https://gogs.soyootech.com/
https://digitalafterlife.org/@lacy0708265363?page=about digitalafterlife.org
http://gitea.wholelove.com.tw:3000/robtfierro0124 gitea.wholelove.com.tw
https://www.beyoncetube.com/@carltisdall27?page=about www.beyoncetube.com
http://git.gkcorp.com.vn:16000/lornadaplyn294 http://git.gkcorp.com.vn:16000/lornadaplyn294
https://skitterphoto.com/photographers/1567647/bond-diaz what can steroids do to you
https://singerdeer2.bravejournal.net/dianabol-dbol-cycle-dosage-stacking-outcomes-and-safety-guide natural steroids
in the body
https://cineblog01.rest/user/tuliplaura9/ natural Anabolics
https://support.mikrodev.com/index.php?qa=user&qa_1=virgoneed9 anabolic
precursor
https://writeablog.net/condorlunge11/dianabol-dbol-cycling-dosage-stack-options-effects-and-safety-tips natural bodybuilding vs steroids
https://b2b2cmarket.ru/user/profile/267303 lean muscle supplements gnc
https://zenwriting.net/furshell4/dianabol-dbol-cycling-101-optimal-doses-stack-combinations-performance muscle
growth steroids
https://docvino.com/forums/users/pockethell0/ valley
https://urlscan.io/result/0199e712-723d-7719-b7b8-1c5ed31b37bf/ best steroid stack to gain muscle
http://historydb.date/index.php?title=stougaardkrogsgaard2845 medical names for steroids
https://hedge.fachschaft.informatik.uni-kl.de/cyxqTEWPTX-6AY99MQbWIw/ best oral steroid for cutting
https://md.un-hack-bar.de/GkT2GD4cTj-37J20lb862A/ valley
https://hack.allmende.io/_21SDuvXSPe05W9P0JrE7w/ steroids for bodybuilding side effects
https://myspace.com/hockeyboard8 legit research chemical supplies sites bodybuilding
https://www.demilked.com/author/ruthchime47/ steroids bodybuilder
https://songcoil43.werite.net/testosterone-enanthate-regimen can steroids be
safe
https://bleezlabs.com/demo/quora/savak/index.php?qa=user&qa_1=judoorgan1 steroid Side effect
https://urlscan.io/result/0199e71c-3923-7528-a7e0-f99b4e2ae001/ risks
of using anabolic steroids and other performance-enhancing drugs
https://able2know.org/user/salmonnut28/ buying steroids online legal
https://old.investaar.ir/forums/users/nailbagel0/ crazy bulk for
Sale
https://urlscan.io/result/0199e724-b081-714e-a564-9d564b21ec50/ deca pills for sale
https://bleezlabs.com/demo/quora/savak/index.php?qa=user&qa_1=benchriver1 anabolic steroid side
effects pictures
https://hays-cross.blogbright.net/mastering-muscle-building-12-steroid-cycles-for-both-novices-and-seasoned-users herbal
Steroids
https://www.tikosatis.com/index.php?page=user&action=pub_profile&id=369581 bodybuilding Steroid
Cycles
https://500px.com/p/odonnellgjeabildgaard where to buy legal steroids
https://iotpractitioner.com/forums/users/oxygendebt5/ anabolic steroids results
https://kanban.xsitepool.tu-freiberg.de/NxQ-Lff2RKe7kFN0y6rFOw/ anabolic steroids risks
https://firsturl.de/JAzkBu6 valley
https://old.investaar.ir/forums/users/nailbagel0/ 2ahukewjkv_v5usvnahvlip4khu09akmq420oa3oecakqcq|the
best steroids for muscle growth
https://pataleta.net/forums/users/trailrobert70/ Steroid Effects
https://pad.hacknang.de/LYI0jFtwRguigKjLxaZ1fw/ different types of steroids and what do they
do
https://to-portal.com/curveleek37 androgenic drugs
https://muhammad-ali.com.az/user/coffeejason41/ where can i get steroids to build muscle
https://pad.hacknang.de/BkTpb_qOS7COwI7ehNXihg/ how
much is steroids
https://able2know.org/user/salmonnut28/ valley
https://apunto.it/user/profile/282047 injection for muscle growth
https://www.instapaper.com/p/16971853 legal
supplements that act like steroids
https://social.muztunes.co/muzsocial-members/sailordavid0/activity/1011409/ all hyperbolic
steroids are also anabolic
http://humanlove.stream//index.php?title=rhodeskenny0263 legal over the counter steroids
https://md.un-hack-bar.de/Ka3mKHr7TNenLg8MiRy_yQ/ valley
https://independent.academia.edu/MichelsenHobbs4 closest thing
to steroids at gnc
https://www.hulkshare.com/cannonrhythm4/ valley
https://b2b2cmarket.ru/user/profile/267221 muscle enhancement pills
https://old.investaar.ir/forums/users/beardriver6/ cheap Anabolic steroids
https://doc.aquilenet.fr/mUDSzoJSRG2bmhTUSANxtA/ bodybuilding new
http://sorucevap.kodmerkezi.net/user/flightstock82 how do you inject steroids
https://output.jsbin.com/getukoduxo/ steroid Cycle chart
https://docs.juze-cr.de/ImdYVXLtQtez7mYkk-py7Q/ golden era
steroid cycles
https://gratisafhalen.be/author/tileplough9/ deca winstrol stack
https://eskisehiruroloji.com/sss/index.php?qa=user&qa_1=windowquilt3 valley
https://www.instapaper.com/p/16974151 alpha cut hd gnc
http://volleypedia.org/index.php?qa=user&qa_1=firednews9 best
lean mass cycle
https://postheaven.net/heliumboard5/dianabol-101-for-new-users-how-to-use-safely-its-advantages-recommended valley
https://kanban.xsitepool.tu-freiberg.de/0BC9BV5lSvO3IqrcPI2H0Q/ best steroid pills for bodybuilding
https://travelersqa.com/user/roompaper1 legal steroids for Women
https://hedgedoc.digillab.uni-augsburg.de/q2wYar_IS8uNNQFxQctHpQ/ valley
https://www.divephotoguide.com/user/maracawalk78 best bodybuilding stack for beginners
https://www.pmsss.in/user/insectbumper1 women on roids
https://output.jsbin.com/faqefifizo/ steroids illegal or
legal
https://motionentrance.edu.np/profile/coatdrop60/ reliable steroid sites
http://historydb.date/index.php?title=stougaardkrogsgaard2845 How
many bodybuilders use steroids
https://docs.juze-cr.de/HZ5J7Oo3RSSko5rljQpvow/ best muscle building pills on the market
https://doc.aquilenet.fr/eCFKROkpReOCz4sNtGIr6w/ steroids that
burn fat fast
https://notes.io/eqAbi can you order steroids online
https://mlx.su/paste/view/7e049fa2 anabolic for sale
https://forum.issabel.org/u/lambnode95 valley
https://blogfreely.net/pickleframe80/dianabol-cycles-and-stacks-the-complete-guide-you-need-to-know valley
https://rentry.co/ky6yn6go workout stacks for beginners
https://sparktv.net/post/874298_https-www-valley-md-dianabol-cycle-benefits-and-risks-testosterone-cypionate-and.html hgh steroids side effects
https://muhammad-ali.com.az/user/brokeriron0/ valley
https://setiathome.berkeley.edu/show_user.php?userid=13273123 the understanding gender is permanent is called
https://pad.stuve.uni-ulm.de/0rrwFMzhQDmo3KPsDAOOUg/ best stacks for muscle gain
https://md.darmstadt.ccc.de/1qxGdTPMRCW6G0lG9obAYA/ best legal steroids on the market
https://www.tikosatis.com/index.php?page=user&action=pub_profile&id=334570 what are steroids
and what do they do
https://md.farafin.de/Dr_AoeZaQWaGBXySl52C3Q/ steroid medical definition
https://pads.jeito.nl/_9zD6hJ9Q0qNTvInCr0sCw/ Purchase Anabolic
Steroids Online
https://independent.academia.edu/KempLoomis2 common Steroid medications
https://www.instapaper.com/p/17021476 bodybuilding supplements forum
https://marshallcountyalabamademocraticparty.com/author/beliefeagle4/ guys on steroids before and after
https://setiathome.berkeley.edu/show_user.php?userid=13235809 anabolic
Steriods
https://marshallcountyalabamademocraticparty.com/author/picklequart75/ d ball steroid pills
https://sfenglishlessons.com/members/matchlip5/activity/532674/ weight loss steroids for sale
https://md.ctdo.de/N1CIU8xQTSm09PBP6ndoew/ valley
https://www.worl.com/animeegypt06/activity/14275/ best place to buy steroids
http://premiumdesignsinc.com/forums/user/sailorfamily1/ cns depressant that was used in body building before it was banned.
https://md.entropia.de/6k3bfq_VQ-uyXc-wKNoAfg/ anavar muscle gains
https://md.ctdo.de/EB6oVnQkTzCoODe2Vtwrfw/ positive effects of steroids on the body
https://marshallcountyalabamademocraticparty.com/author/guidefog47/ Best way to inject Steroids
https://pad.stuve.uni-ulm.de/q2A5TQ5_SCaUEzrhLpjYfg/ winstrol tabs results
https://docs.juze-cr.de/ZviI79GcQMCUEPMls04gqg/ valley
https://independent.academia.edu/GuthrieFinley1 strongest oral steroids
https://synergycommons.net/forums/users/writerjewel58/ strongest legal
steroid on the market
https://rockchat.com/members/pocketswamp4/activity/94632/ medical name For steroids
https://www.demilked.com/author/brokerbanker8/ valley
https://id.crapaud-fou.org/crapaud/boxguitar55 steroids uses and side effects
https://www.divephotoguide.com/user/drakecornet11 valley
https://marshallcountyalabamademocraticparty.com/author/guidefog47/ anabolic steroids withdrawal
https://md.swk-web.com/SEkCCU-WSw60-xUuUv0Uqw/ What Does A Steroid Look Like
https://md.ctdo.de/N1CIU8xQTSm09PBP6ndoew/ valley
https://gratisafhalen.be/author/cherrydragon23/ valley
http://ezproxy.cityu.edu.hk/login?url=https://www.valley.md/dianabol-cycle-benefits-and-risks dianabol And Deca stack
https://schoolido.lu/user/burstnote47/ why are anabolic steroids
illegal
http://masjidwasl.com/members/manplier38/activity/103211/ extreme muscle enhancement
https://writeablog.net/agecrocus6/sustanon-250-and-dbol-complete-cycle-guide-dosages-and-risks Legal steroids For
muscle gain
https://synergycommons.net/forums/users/applecheck2/ legal steroids safe
https://to-portal.com/dryereagle1 valley
https://notes.io/wQTVH valley
https://www.zamsh.com/author/busotter2/ Steroids Make You Gain Weight
https://ljs.fun:19000/fredericskertc ljs.fun
https://onedance.tv/@jannie90f08461?page=about onedance.tv
https://git.influxfin.com/leoniemaltby9 git.influxfin.com
https://git.17pkmj.com:3000/albertripley27 https://git.17pkmj.com/
http://www.w003.cloud:8418/raphaelhayward www.w003.cloud
https://git.becks-web.de/vivianhimmel69 https://git.becks-web.de/vivianhimmel69
https://mardplay.com/rashadbuss000 mardplay.com
https://www.jr-it-services.de:3000/janniewilber0 https://www.jr-it-services.de:3000/janniewilber0
https://niqnok.com/rafaelahanna9 niqnok.com
https://gitea.potatox.net/greg52k4720173 https://gitea.potatox.net
https://git.rec4box.com/samanthatruebr https://git.rec4box.com/samanthatruebr
https://finalresult.buzz/floridasever74 finalresult.buzz
http://www.huastech.com.cn:81/harveyl1526238 http://www.huastech.com.cn
https://520.dj/cecilaramaciot 520.dj
http://dengle.cc:3000/ohyrene6370018 http://dengle.cc:3000/ohyrene6370018
https://git.arx-obscura.de/fwtscarlett17 git.arx-obscura.de
https://bantooplay.com/@breth099139595?page=about bantooplay.com
http://www.ntopia-tech.com:30000/brittanydowden http://www.ntopia-tech.com:30000/brittanydowden
https://git.manabo.org/elbertypj34893 git.manabo.org
https://hafrikplay.com/shastahauslaib hafrikplay.com
https://git.ecq.jp/odellcrook691 https://git.ecq.jp
https://theudtaullu.com/@nicolas1157835?page=about theudtaullu.com
https://www.simpra.org:3000/harryb59050909 www.simpra.org
https://gitea.marvinronk.com/maxwellfaulk2 https://gitea.marvinronk.com/maxwellfaulk2
https://sounddeep.blacktube.in/paula793952460 https://sounddeep.blacktube.in/paula793952460
https://git.vce.de/georgetakasuka git.vce.de
http://gitee.mrsang.cfd/justinmcgowan9 gitee.mrsang.cfd
https://gitea.dcqrr.top:83/caroliredale4 gitea.dcqrr.top
https://platform.giftedsoulsent.com/oren93t2154652 https://platform.giftedsoulsent.com/oren93t2154652
https://git.srv.ink/haimchale10743 https://git.srv.ink/haimchale10743
https://git.droenska.com/tobiasupfield git.droenska.com
https://meetdatingpartners.com/@stevenfinnis51 meetdatingpartners.com
https://dating.hyesearch.com/@raaalfred90293 dating.hyesearch.com
https://thescouter.co.uk/@octavialabelle?page=about thescouter.co.uk
https://pleroma.cnuc.nu/joeysaranealis https://pleroma.cnuc.nu/
https://www.adultgg.com/@octaviamartine?page=about adultgg.com
https://jovita.com/zellanewquist jovita.com
https://voicync.com/kalimidgette4 voicync.com
https://sound.descreated.com/aliciachinnery sound.descreated.com
https://git.malls.iformall.com/dawnlemons5089 https://git.malls.iformall.com/dawnlemons5089
https://jovita.com/margeryc204133 jovita.com
https://code.dsconce.space/kathilinville9 code.dsconce.space
https://git.srblerp.com/sharistable45 https://git.srblerp.com/sharistable45
https://gitea.my-intrudair.com/augustakingsfo gitea.my-intrudair.com
https://nemesisgit.com/corrinerasp09 https://nemesisgit.com/
https://nrisoulmate.com/@cheriepink228 nrisoulmate.com
https://www.singuratate.ro/@gavinbermingha https://www.singuratate.ro/
https://badoo.camanchacapp.cl/@raina49x616086 badoo.camanchacapp.cl
https://git.fandiyuan.com/dalenepitcairn git.fandiyuan.com
https://ngoma.app/richardbladen0 ngoma.app
https://git0.zpqrtbnk.net/chufairbairn23 git0.zpqrtbnk.net
https://www.lizyum.com/@melvinawerfel https://www.lizyum.com
https://gitea.blubeacon.com/stefaniedarbon gitea.blubeacon.com
https://git.wisder.net/vitocazares56 git.wisder.net
https://git.rpjosh.de/muhammad34p794 git.rpjosh.de
https://asixmusik.com/irvinggrillo40 https://asixmusik.com/
https://git.successkaoyan.com/qramargret765 git.successkaoyan.com
https://git0.zpqrtbnk.net/zffterri866764 git0.zpqrtbnk.net
https://gitea.boner.be/lorrierincon44 gitea.boner.be
http://spnewstv.com/@jillianmerry07?page=about spnewstv.com
https://sound.ukrsocial.com.ua/angleak440878 sound.ukrsocial.com.ua
https://gitea.shirom.me/eleanore148218 gitea.shirom.me
https://gitea.fuluzhanggui.com:99/arnold46o96008 https://gitea.fuluzhanggui.com/
https://git.van-peeren.de/liamponce11905 https://git.van-peeren.de/
https://devkona.net/francescawan66 devkona.net
https://slowdating.ca/@mohamedgore638 https://slowdating.ca/@mohamedgore638
https://gitea.kdlsvps.top/joannglennie67 https://gitea.kdlsvps.top/joannglennie67
https://git.nuansa.co.id/erick991775223 git.nuansa.co.id
https://git.lokalix.de/kassandravalle git.lokalix.de
https://scrape.weidautzel.de/arethamarchant scrape.weidautzel.de
https://echbar.online/earnestine65v4 echbar.online
https://git.7milch.com/juan658385934 https://git.7milch.com/juan658385934
https://gitea.uchung.com/elizabethhatma https://gitea.uchung.com
https://www.nenboy.com:29283/jerroldjenson www.nenboy.com
https://karnena.com/amieacker04950 https://karnena.com/amieacker04950
https://clone-deepsound.paineldemonstrativo.com.br/ramonawhiteleg clone-deepsound.paineldemonstrativo.com.br
https://tur.my/hellentait539 tur.my
https://daterondetjolie.fr/@adakump2737284 daterondetjolie.fr
http://www.huastech.com.cn:81/lmzlauna899370 www.huastech.com.cn
http://share.pkbigdata.com/zulmavalazquez http://share.pkbigdata.com/zulmavalazquez
https://rhapsodyofrealities.abilliontestimoniesandmore.org/@brooksabo73433?page=about rhapsodyofrealities.abilliontestimoniesandmore.org
http://guishenking.cloud:3000/garnetcropper4 http://guishenking.cloud
https://git.kitti.ac.th/andydoorly871 git.kitti.ac.th
https://play.talkdrove.cc.nf/@nannettemares?page=about https://play.talkdrove.cc.nf/@nannettemares?page=about
https://kition.mhl.tuc.gr/palmabrake0488 https://kition.mhl.tuc.gr
https://gitea.visoftware.com.co/dorcas44t39775 gitea.visoftware.com.co
https://home.zhupei.me:3000/reneedavila347 home.zhupei.me
https://adufoshi.com/roderickbaeza adufoshi.com
https://www.hyzq123.com/@moshechild002?page=about https://www.hyzq123.com/@moshechild002?page=about
https://meeting2up.it/@nevillegammon meeting2up.it
https://tehranafro.com/bernardocasill https://tehranafro.com/
https://www.k0ki-dev.de/neilmpu899263 www.k0ki-dev.de
https://primeplayer.in/@orvalneil24471?page=about primeplayer.in
http://repo.bpo.technology/azucenaeatock2 repo.bpo.technology
http://git.gkcorp.com.vn:16000/laurene910118 git.gkcorp.com.vn
https://git.erdei-dev.hu/gabriellemedlo https://git.erdei-dev.hu/gabriellemedlo
https://repo.apps.odatahub.net/damonkauper338 repo.apps.odatahub.net
https://git.jbangit.com/larrybox49446 git.jbangit.com
http://bot.61ns.com:3000/antjeconti144 http://bot.61ns.com/
https://bluebirdmusic.in/@ricoreid199767?page=about https://bluebirdmusic.in/@ricoreid199767?page=about
http://gitea.danongshu.cn/niklasj217019 gitea.danongshu.cn
https://git.becks-web.de/darrelgrey6473 https://git.becks-web.de/
https://hafrikplay.com/corinabeal3342 hafrikplay.com
https://tippy-t.com/efcclarice7552 https://tippy-t.com/efcclarice7552
https://primeplayer.in/@orvalneil24471?page=about primeplayer.in
https://git0.zpqrtbnk.net/leopoldogocher git0.zpqrtbnk.net
https://tur.my/marilou5671890 tur.my
http://gitea.dctpay.com/sanfordfennesc gitea.dctpay.com
https://worship.com.ng/colininouye157 https://worship.com.ng/colininouye157
https://gitea.dusays.com/latosha09j6296 gitea.dusays.com
https://gitea.dcqrr.top:83/renalovegrove4 https://gitea.dcqrr.top
https://git.dsvision.net/stan3956027752 https://git.dsvision.net/stan3956027752
https://www.enginx.dev/rachelestackho https://www.enginx.dev/
https://vcs.int.feuerwehr-ziemetshausen.de/julienneparkin vcs.int.feuerwehr-ziemetshausen.de
https://spinvai.com/vernonbousquet spinvai.com
https://ngoma.app/adolphpeterman https://ngoma.app
https://sound.descreated.com/marisaweigel57 sound.descreated.com
https://tiktok.dnacceler.com/@marcoddie49091?page=about https://tiktok.dnacceler.com/@marcoddie49091?page=about
https://asixmusik.com/abbiei29665085 https://asixmusik.com/abbiei29665085
https://520.dj/madiestandish3 520.dj
https://m.hrjh.org/alejandro07361 https://m.hrjh.org/alejandro07361
https://git.autotion.net/mayrah14830744 https://git.autotion.net
https://tippy-t.com/robertfredrick tippy-t.com
https://git.lokalix.de/emilmallard506 https://git.lokalix.de/emilmallard506
https://music.michaelmknight.com/noeknaggs56689 music.michaelmknight.com
https://gitea.gimmin.com/sasha592712494 https://gitea.gimmin.com/sasha592712494
https://git.erdei-dev.hu/jaredeather49 https://git.erdei-dev.hu/jaredeather49
https://ceedmusic.com/jacksonavu4169 ceedmusic.com
https://www.nenboy.com:29283/vincent519126 www.nenboy.com
https://adufoshi.com/williamsmccaul https://adufoshi.com/williamsmccaul
https://music.magic-pics.tk/jefferypiedra music.magic-pics.tk
https://git.bpcspace.com/carmella76z414 git.bpcspace.com
https://git.temporaryname.org/joliekeesler74 https://git.temporaryname.org/joliekeesler74
https://git.van-peeren.de/angeline876622 git.van-peeren.de
https://git.17pkmj.com:3000/lavernsteinmet https://git.17pkmj.com
http://gitea.mintelcn.com/rhondalander97 gitea.mintelcn.com
https://circassianweb.com/video/@robbintate4700?page=about https://circassianweb.com/video/@robbintate4700?page=about
https://git.agri-sys.com/winifredbelang git.agri-sys.com
https://git.asdf.cafe/phoebep995663 https://git.asdf.cafe/
https://datebaku.com/@gilbertoconde1 datebaku.com
http://gitea.mintelcn.com/rhondalander97 http://gitea.mintelcn.com/rhondalander97
https://git.winscloud.net/bernadinekotte https://git.winscloud.net
https://www.tmip.com.tr/@taylap00468197?page=about tmip.com.tr
https://askmilton.tv/@mayrapoe863592?page=about askmilton.tv
http://guishenking.cloud:3000/eugeneheap1091 http://guishenking.cloud:3000/eugeneheap1091
https://circassianweb.com/video/@silas247994131?page=about circassianweb.com
https://gitlab.ui.ac.id/monajacobsen73 gitlab.ui.ac.id
https://git.esc-plus.com/trevorbland09 https://git.esc-plus.com/trevorbland09
https://platform.giftedsoulsent.com/plucarmelo9739 https://platform.giftedsoulsent.com/plucarmelo9739
https://mockway.cpolar.top/xytbarbra0645 mockway.cpolar.top
https://git.smartenergi.org/jacquettabanks git.smartenergi.org
https://www.canaddatv.com/@felix95w040257?page=about www.canaddatv.com
https://git.emanuelemiani.it/kitwilkes3016 git.emanuelemiani.it
https://gitea.mocup.org/madonnariley8 https://gitea.mocup.org
https://gitea.visoftware.com.co/darwinhatten55 https://gitea.visoftware.com.co/darwinhatten55
https://www.simpra.org:3000/marilouseale43 https://www.simpra.org
https://gt.clarifylife.net/troy16a9160580 https://gt.clarifylife.net/
https://git.juici.ly/alinehensley41 git.juici.ly
https://git.4lcap.com/deneenpemulwuy git.4lcap.com
http://gitea.ucarmesin.de/brentbeckenbau gitea.ucarmesin.de
http://dev.baidubaoche.com/margery3335596 http://dev.baidubaoche.com/
http://test-www.writebug.com:3000/milanditter20 http://test-www.writebug.com:3000/milanditter20
https://git.berfen.com/kathicastle896 git.berfen.com
http://dibodating.com/@kennithloar937 http://dibodating.com
https://gitea.codedbycaleb.com/adamw560293250 https://gitea.codedbycaleb.com/adamw560293250
http://share.pkbigdata.com/janettrumper21 share.pkbigdata.com
https://git.rbsx.de/ariellebertles https://git.rbsx.de/ariellebertles
https://git.sgap.uk/josefad9099659 git.sgap.uk
https://git.louislabs.com/cruzethridge0 git.louislabs.com
https://git.zimerguz.net/dominicheron9 git.zimerguz.net
http://nas.bi1kbu.com:8418/nidabugnion221 http://nas.bi1kbu.com:8418/nidabugnion221
https://theindievibes.com/samualvaldez2 theindievibes.com
https://git.wun.im/deidrebendrodt git.wun.im
https://megastream.pl/@marlenerobert?page=about megastream.pl
https://quenly.com/@jacintomcnicol quenly.com
https://phoebe.roshka.com/gitlab/alysafowler57 phoebe.roshka.com
http://www.ntopia-tech.com:30000/latashiangf10 www.ntopia-tech.com
https://nas.zearon.com:2001/lucillegillila nas.zearon.com
https://qarisound.com/stepaniedehame qarisound.com
https://nas.zearon.com:2001/angela03j0273 nas.zearon.com
https://intalnirisecrete.ro/@ambroseoverton intalnirisecrete.ro
https://git.lolpro11.me/kristinhillen4 https://git.lolpro11.me
https://www.soundofrecovery.org/norabisdee5288 https://www.soundofrecovery.org
http://aimusicitalia.it/kimberlydedman aimusicitalia.it
https://musixx.smart-und-nett.de/allen50205684 https://musixx.smart-und-nett.de/allen50205684
https://git.crudelis.kr/ashlicardone7 git.crudelis.kr
https://hiphopmusique.com/bridgettestamp https://hiphopmusique.com
https://thefusionflix.com/@jackbowie62936?page=about thefusionflix.com
https://daterondetjolie.fr/@tyroneyagan59 https://daterondetjolie.fr/
https://git.van-peeren.de/earnestine2690 git.van-peeren.de
https://myafritube.com/@johnsonrife201?page=about myafritube.com
https://www.herzog-it.de/mei99p7308605 https://www.herzog-it.de/mei99p7308605
https://645123.com/@trena01m583942?page=about 645123.com
https://music.vp3.me/bobbyecourts52 music.vp3.me
https://git.zimerguz.net/franziskamcdou https://git.zimerguz.net/
https://git.fhlz.top/omrbrook449819 git.fhlz.top
https://www.musicsound.ca/winonam947411 https://www.musicsound.ca/winonam947411
https://git.ncue.net/joelfolsom4083 git.ncue.net
https://git.moguyn.cn/trinateague41 git.moguyn.cn
https://sheyiyuan.cn/vickeykump535 https://sheyiyuan.cn/
http://9dnakedeye.com.cn:9001/meridithhambli 9dnakedeye.com.cn
https://www.italia24.tv/tube/@helen870227701?page=about https://www.italia24.tv/tube/@helen870227701?page=about
https://gitea.micro-stack.org/dakotanutt5176 https://gitea.micro-stack.org/dakotanutt5176
https://git.tea-assets.com/danialmccleman git.tea-assets.com
https://freevideocanal.com/@siennacambell?page=about freevideocanal.com
https://isabelzarate.com/ronnylci803823 https://isabelzarate.com
https://sound.floofbite.com/nnmlorna896367 sound.floofbite.com
https://askmilton.tv/@karasanchez31?page=about https://askmilton.tv
https://pilowtalks.com/@shaundillon362 https://pilowtalks.com/@shaundillon362
https://gitea.ashcloud.com/julieta96u4788 https://gitea.ashcloud.com
http://www.mindepoch.com:9092/tatianasteger www.mindepoch.com
https://virnal.com/@mohammedschmid?page=about virnal.com
https://intalnirisecrete.ro/@ambroseoverton intalnirisecrete.ro
https://git.malls.iformall.com/ninadonoghue18 https://git.malls.iformall.com
https://www.kornerspot.com/@nidiadoughty6 https://www.kornerspot.com
https://git.louhau.edu.mo/ladonnaschmitz git.louhau.edu.mo
https://omegat.dmu-medical.de/lawannafirkins https://omegat.dmu-medical.de/lawannafirkins
https://gitea.cncfstack.com/emilysomers394 gitea.cncfstack.com
https://git.sudo-fhir.au/helenhuang5707 git.sudo-fhir.au
https://git.rankenste.in/vernita082459 git.rankenste.in
https://www.ituac.com/latishacrum602 www.ituac.com
https://great-worker.com/raymondelkingt great-worker.com
https://git.cukak.com/linettebrown60 https://git.cukak.com
https://git.werkraum-karlsruhe.org/lonaq607049009 https://git.werkraum-karlsruhe.org/lonaq607049009
https://zurimeet.com/@cheri468070473 zurimeet.com
http://cloud.sunlab.top:3000/cruzmoffet3282 cloud.sunlab.top
https://www.ituac.com/latishacrum602 www.ituac.com
https://matchmadeinasia.com/@darinsellheim https://matchmadeinasia.com/@darinsellheim
http://gitea.ucarmesin.de/brentbeckenbau gitea.ucarmesin.de
https://primeplayer.in/@bufordv8233297?page=about https://primeplayer.in
https://gitea.marvinronk.com/annabelle59322 https://gitea.marvinronk.com
https://git.zhukovsky.me/kristopherdeva git.zhukovsky.me
https://git.healthathome.com.np/pauline850403 git.healthathome.com.np
http://gitea.yunshanghub.com:8081/sonyacarbajal gitea.yunshanghub.com
https://git.lolpro11.me/kristinhillen4 git.lolpro11.me
https://www.cadquos.dev/odessajaeger1 www.cadquos.dev
https://forge.coreymclark.com/keithhopman504 forge.coreymclark.com
https://viraltry.com/@staceymendes8?page=about https://viraltry.com/@staceymendes8?page=about
https://gitea.abra.me/mattie59062511 gitea.abra.me
https://www.lizyum.com/@melvinawerfel www.lizyum.com
https://platform.giftedsoulsent.com/lannyelsberry platform.giftedsoulsent.com
https://cupido.prestigioapps.com/@mairarundle29 https://cupido.prestigioapps.com
http://wangchongwu.vicp.fun:3333/zackgarrick753 wangchongwu.vicp.fun
http://www.w003.cloud:8418/raphaelhayward http://www.w003.cloud/
https://naijasingles.net/@ingeucy484093 naijasingles.net
https://surily.in/angelitalatrob surily.in
https://quickplay.pro/zane8786284524 https://quickplay.pro/
https://gitea.thanh0x.com/auguststreeter gitea.thanh0x.com
https://www.fastmarry.com/@rosellalavin53 https://www.fastmarry.com/@rosellalavin53
https://git.ellinger.eu/terranceglasgo https://git.ellinger.eu/terranceglasgo
https://vcs.int.feuerwehr-ziemetshausen.de/dinahcountryma vcs.int.feuerwehr-ziemetshausen.de
https://thescouter.co.uk/@curtnutt36921?page=about thescouter.co.uk
https://katambe.com/@merissaz642138 https://katambe.com/
https://ubuntushows.com/@dneannett1741?page=about https://ubuntushows.com
https://gitea.springforest.top/aprilstreeten gitea.springforest.top
https://git.51aspx.com/annabellebenne git.51aspx.com
https://www.k0ki-dev.de/lazaroingham2 www.k0ki-dev.de
https://audioedu.kyaikkhami.com/rethavines1044 https://audioedu.kyaikkhami.com
https://git.hundseth.com/louisacbl8978 git.hundseth.com
https://clikview.com/@rubymacrossan?page=about clikview.com
https://hgngit.ipdz.me/maybellgilroy https://hgngit.ipdz.me/
https://git.anacsoft.com/landonthatcher git.anacsoft.com
https://git.yuhong.com.cn/juliemccranie1 git.yuhong.com.cn
https://gitea.visoftware.com.co/dorcas44t39775 gitea.visoftware.com.co
http://dengle.cc:3000/carlotamcdade0 dengle.cc
https://dreamplacesai.de/charleyaudet93 https://dreamplacesai.de/charleyaudet93
https://computerhalle.eu/isiskeogh0649 https://computerhalle.eu/
https://mahalkita.ph/@bradymoor93499 mahalkita.ph
https://git.malls.iformall.com/alvaroprisco27 git.malls.iformall.com
https://easyconnect.fun/@karen63y131128 https://easyconnect.fun
https://audioedu.kyaikkhami.com/rethavines1044 audioedu.kyaikkhami.com
https://meetdatingpartners.com/@stevenfinnis51 https://meetdatingpartners.com/
https://home.zhupei.me:3000/horaciodesalis https://home.zhupei.me
https://megastream.pl/@abbycousins339?page=about megastream.pl
https://gitea.sosaley.in/breannaknetes https://gitea.sosaley.in/breannaknetes
https://git.hexaquo.at/lynellcarrera9 https://git.hexaquo.at/lynellcarrera9
https://git.hexaquo.at/lynellcarrera9 https://git.hexaquo.at/lynellcarrera9
https://video.cheeft.com/@ceciles6623004?page=about https://video.cheeft.com/@ceciles6623004?page=about
https://www.herzog-it.de/emanuelgeorgin www.herzog-it.de
https://maru.bnkode.com/@gina94l7238903 maru.bnkode.com
https://pleroma.cnuc.nu/marisafarnham https://pleroma.cnuc.nu/marisafarnham
https://viraltry.com/@lilatunbridge1?page=about viraltry.com
https://git.autotion.net/elizabetmccork git.autotion.net
https://dev.dhf.icu/carmonunger053 https://dev.dhf.icu/
https://gitea.belanjaparts.com/modestaregan49 gitea.belanjaparts.com
https://git.auwiesen2.de/theogallardo62 https://git.auwiesen2.de/theogallardo62
https://git.connectplus.jp/benitoerb25142 git.connectplus.jp
https://slowdating.ca/@lenorabledsoe0 slowdating.ca
https://cineraworld.com/@jefferey92q661?page=about https://cineraworld.com/@jefferey92q661?page=about
https://git.zhukovsky.me/chasetoutcher git.zhukovsky.me
https://meetme.goo.ng/@lachlan01k4754 meetme.goo.ng
https://git.rokiy.com/pauletteantoni https://git.rokiy.com/pauletteantoni
https://g.6tm.es/kami598207732 https://g.6tm.es
https://git.unicom.studio/rochellemccall git.unicom.studio
https://git.wun.im/deidrebendrodt git.wun.im
https://git.malls.iformall.com/monikablount5 https://git.malls.iformall.com/monikablount5
https://git.srblerp.com/murrayhutchens git.srblerp.com
https://gitea.b54.co/fernepagan1368 gitea.b54.co
https://git.karma-riuk.com/juanaaunger71 git.karma-riuk.com
https://cacklehub.com/@demetracuh3446?page=about cacklehub.com
https://gogolive.biz/@grantspowers5?page=about https://gogolive.biz/
https://ionvideo.org/@aleciaarmfield?page=about ionvideo.org
https://gitea.quiztimes.nl/unanewbigin55 gitea.quiztimes.nl
https://kayesbamusic.com/jesusfawsitt52 kayesbamusic.com
https://clikview.com/@jesusrahman376?page=about clikview.com
https://gitea.cncfstack.com/galencarrillo6 https://gitea.cncfstack.com
https://meeting2up.it/@raleighfiorini meeting2up.it
https://gitea.ysme.top/oliviaeyre243 gitea.ysme.top
https://git.erdei-dev.hu/leonardmillike git.erdei-dev.hu
https://sithcom.de/mkejeremy95170 https://sithcom.de/
https://gitea.ideaopen.cn/franklindoolit https://gitea.ideaopen.cn
https://git.winscloud.net/isaacyokoyama5 git.winscloud.net
https://git.moguyn.cn/keithtrudeau75 git.moguyn.cn
https://qimley.com/@rachelejenkin qimley.com
https://git.srblerp.com/nellycorones6 https://git.srblerp.com
https://geniusactionblueprint.com/@steffenmadsen4?page=about https://geniusactionblueprint.com
https://rearch.engineer/adbrichelle763 https://rearch.engineer
https://movieplays.net/@vilmabushby526?page=about movieplays.net
https://pleroma.cnuc.nu/stephainewhite pleroma.cnuc.nu
http://spnewstv.com/@jillianmerry07?page=about spnewstv.com
https://romancefrica.com/@pilarcoulter88 https://romancefrica.com/
https://gitea.sosaley.in/jetthoskin3661 gitea.sosaley.in
https://grabtv.xyz/@ariannefrankly?page=about grabtv.xyz
https://git.palagov.tv/corinelockwood https://git.palagov.tv/corinelockwood
https://gitea.quiztimes.nl/vaniabouchard5 gitea.quiztimes.nl
https://gitea.abra.me/gerardochaney gitea.abra.me
https://git.aopcloud.com/jeannestrange git.aopcloud.com
https://truesecret.org/@lourdesa79839?page=about truesecret.org
https://ubuntushows.com/@dneannett1741?page=about ubuntushows.com
https://video.etowns.ir/@candracrider57?page=about video.etowns.ir
https://cutenite.com/@franklynj53493 cutenite.com
https://truthtube.video/@honghanslow04?page=about https://truthtube.video/@honghanslow04?page=about
https://datingmywish.com/@lacysjq8993482 https://datingmywish.com/@lacysjq8993482
https://cutenite.com/@rubincollette8 https://cutenite.com/@rubincollette8
https://git.smartenergi.org/deborahfrias7 git.smartenergi.org
https://play.talkdrove.cc.nf/@barretthartman?page=about play.talkdrove.cc.nf
https://koseongnam.com/phildet259161 koseongnam.com
https://quickdatescript.com/@heathpedigo603 https://quickdatescript.com
https://gt.clarifylife.net/troy16a9160580 https://gt.clarifylife.net/troy16a9160580
https://primeplayer.in/@gertrudesalcid?page=about primeplayer.in
https://git.agri-sys.com/lakeshawentwor https://git.agri-sys.com
https://gitea.chaos-it.pl/joseedward035 https://gitea.chaos-it.pl/joseedward035
http://sheyiyuan.cn:3000/lonnastory3089 sheyiyuan.cn
https://git.deadpoo.net/summermollison git.deadpoo.net
https://gitea.quiztimes.nl/jordanmorrisse https://gitea.quiztimes.nl/
https://hgngit.ipdz.me/jeannettedudle https://hgngit.ipdz.me/
https://katambe.com/@zacqcp22692805 katambe.com
https://video.etowns.ir/@lucio56218599?page=about video.etowns.ir
http://cloud.sunlab.top:3000/kiaravarghese cloud.sunlab.top
http://guishenking.cloud:3000/hiramreagan000 guishenking.cloud
https://git.agusandelnorte.gov.ph/cooperdaniel1 git.agusandelnorte.gov.ph
https://vidspaceaiapp.com/@alexisduncombe?page=about vidspaceaiapp.com
https://vcs.int.feuerwehr-ziemetshausen.de/evelynejenks1 https://vcs.int.feuerwehr-ziemetshausen.de/
https://git.cloud.leonclassroom.com/carlpendley039 https://git.cloud.leonclassroom.com/
https://code.openmobius.com:3001/shalandakight code.openmobius.com
https://git.wun.im/deidretrimble0 https://git.wun.im/deidretrimble0
https://silatdating.com/@eleanoreglauer https://silatdating.com/@eleanoreglauer
https://slowdating.ca/@kendrickbunton https://slowdating.ca/
https://dev.dhf.icu/beulahs6264147 dev.dhf.icu
https://auric-org.org/kurtisk5570311 https://auric-org.org/kurtisk5570311
https://git.atomos.io/priscillanicke https://git.atomos.io/priscillanicke
https://wiki.idealirc.org/jaimehurd77334 wiki.idealirc.org
https://gitea.thanh0x.com/loikellye2606 https://gitea.thanh0x.com/loikellye2606
https://kition.mhl.tuc.gr/florriemacartn https://kition.mhl.tuc.gr/florriemacartn
https://cameotv.cc/@ernestinamacla?page=about cameotv.cc
https://gitea.abra.me/jamelsherlock gitea.abra.me
https://play-vio.com/@ewanogilby9672?page=about https://play-vio.com/@ewanogilby9672?page=about
https://git.daoyoucloud.com/leonornielson6 git.daoyoucloud.com
https://git.techspec.pro/albachapman16 git.techspec.pro
https://git.noxxxx.com/joannebooth89 git.noxxxx.com
https://spinvai.com/rolandodougher spinvai.com
https://sistemagent.com:8081/zpkreginald254 sistemagent.com
http://git.fbonazzi.it/alberto7233245 git.fbonazzi.it
https://gitea.ashcloud.com/teena09i709639 https://gitea.ashcloud.com
https://m.hrjh.org/catalinaeck868 m.hrjh.org
http://www.tm-jikayo.com:8081/demetriabiraba http://www.tm-jikayo.com:8081/demetriabiraba
https://sound.descreated.com/lawerenceround sound.descreated.com
https://git.rankenste.in/brandiebrendel git.rankenste.in
https://w2k.sh/loviefurphy31 w2k.sh
https://matchmingle.fun/@raleighstrong https://matchmingle.fun
https://www.chenisgod.com:3096/willardmoritz chenisgod.com
https://git.rbsx.de/florenciabiven https://git.rbsx.de
https://smusic.sochey.com/stephainerudol smusic.sochey.com
https://git.xemo-net.de/marcelinotinda git.xemo-net.de
https://tehranafro.com/poppywofford3 tehranafro.com
http://git.datanest.gluc.ch/dieterdenson93 http://git.datanest.gluc.ch/
https://vcs.int.feuerwehr-ziemetshausen.de/julienneparkin https://vcs.int.feuerwehr-ziemetshausen.de/
https://git.ghostpacket.org/autumnmcnulty8 https://git.ghostpacket.org
https://gitea.uchung.com/elizabethhatma gitea.uchung.com
https://git.berfen.com/elizbethbarrie git.berfen.com
https://gitimpo.liara.run/willyknopwood https://gitimpo.liara.run
https://git.van-peeren.de/edgarpomeroy60 git.van-peeren.de
https://music.magic-pics.tk/uxkjestine376 music.magic-pics.tk
https://music.paywork.ao/chongj78099021 https://music.paywork.ao/chongj78099021
https://play.future.al/@fcjabbey260844?page=about play.future.al
https://truesecret.org/@lourdesa79839?page=about https://truesecret.org
https://dating.hyesearch.com/@karolynlloyd9 https://dating.hyesearch.com/
https://isabelzarate.com/terisneed11501 isabelzarate.com
https://pleroma.cnuc.nu/nataliechesser https://pleroma.cnuc.nu/nataliechesser
https://g.6tm.es/kieranveitch89 https://g.6tm.es
https://www.ituac.com/francescagnh54 https://www.ituac.com/francescagnh54
https://www.kornerspot.com/@andersonmetter www.kornerspot.com
https://nemesisgit.com/miquelrudd6892 nemesisgit.com
https://gitea.micro-stack.org/alejandrinaemb gitea.micro-stack.org
https://git.srv.ink/merissasaragos git.srv.ink
https://playxtream.com/@leandraguess0?page=about playxtream.com
https://media.izandu.com/@ernestosikes68?page=about media.izandu.com
https://tur.my/janie676699852 tur.my
https://git.bremauer.cc/elijahstretch https://git.bremauer.cc
https://git.fasteur.cn/lelandboatrigh git.fasteur.cn
https://artbeninshow.afiganmey.com/shannonmcafee1 artbeninshow.afiganmey.com
http://git.wanggaofeng.cn:3000/morrisyxn32314 http://git.wanggaofeng.cn
https://git.alexerdei.co.uk/maryanne20u026 https://git.alexerdei.co.uk/
https://git.rpjosh.de/vickistyles027 https://git.rpjosh.de
http://voicebot.digitalakademie-bw.de:3000/juliannmorehou voicebot.digitalakademie-bw.de
http://smandamlg.com/vibe/@victoriacoane2?page=about http://smandamlg.com/vibe/@victoriacoane2?page=about
https://git.saintdoggie.org/maryellenlever git.saintdoggie.org
https://meetme.goo.ng/@jeannarayner98 meetme.goo.ng
https://git.agri-sys.com/louella53b7722 git.agri-sys.com
https://git.louhau.edu.mo/floridawoolaco https://git.louhau.edu.mo/floridawoolaco
http://git.yanei-iot.com:600/aprilsingh296 git.yanei-iot.com
https://echbar.online/earnestine65v4 echbar.online
https://www.beyoncetube.com/@earnestineuxe?page=about www.beyoncetube.com
https://git.emanuelemiani.it/alberthapaul82 https://git.emanuelemiani.it/alberthapaul82
https://gitea.johannes-hegele.de/cerysdurant089 gitea.johannes-hegele.de
https://git.westeros.fr/blythedeschamp https://git.westeros.fr/blythedeschamp
https://www.arabianmatrimony.com/@bradleyfereday https://www.arabianmatrimony.com
https://www.sugarmummyx.com/@marcelognp913?page=about www.sugarmummyx.com
http://sheyiyuan.cn:3000/lonnastory3089 sheyiyuan.cn
https://freshtube.net/@williecranwell?page=about freshtube.net
https://viraltry.com/@manuelstawell1?page=about viraltry.com
https://gitea.synapsetec.cn/maggiesprouse gitea.synapsetec.cn
https://git.lodis.se/rosalindaparri git.lodis.se
https://git.dsvision.net/stan3956027752 git.dsvision.net
https://qabeelah.com/@leighdarden39?page=about https://qabeelah.com/@leighdarden39?page=about
https://alelo.org/@jaimemccrary0 alelo.org
https://git.noxxxx.com/petebussell95 https://git.noxxxx.com
https://kayesbamusic.com/bernie65907474 https://kayesbamusic.com
https://520.dj/cecilaramaciot https://520.dj/cecilaramaciot
https://git.lokalix.de/editheatock831 git.lokalix.de
https://ngoma.app/jeremyberman73 https://ngoma.app/jeremyberman73
https://gitea.marvinronk.com/felicitas42v20 gitea.marvinronk.com
https://nuhweh.com/kishalusk20937 https://nuhweh.com
http://dengle.cc:3000/bartlyon78092 dengle.cc
http://www.factory18.cn/wvalouie731608 http://www.factory18.cn
https://git.palagov.tv/sangreyes08315 https://git.palagov.tv/
https://gitea.ysme.top/mozellemaclean gitea.ysme.top
https://git.winscloud.net/elliotbeavers git.winscloud.net
http://git.fbonazzi.it/sherryh594448 git.fbonazzi.it
https://music.growverse.net/loreennormanby https://music.growverse.net/loreennormanby
https://smusic.sochey.com/liamalbright5 smusic.sochey.com
https://gitimpo.liara.run/hellen19p77417 https://gitimpo.liara.run/
https://meetme.goo.ng/@maddisoniqbal meetme.goo.ng
https://git0.zpqrtbnk.net/chufairbairn23 https://git0.zpqrtbnk.net/
https://dating.hyesearch.com/@sheririos20630 https://dating.hyesearch.com/
https://tintinger.org/harlancrandall tintinger.org
https://nrisoulmate.com/@upjluella01788 https://nrisoulmate.com/@upjluella01788
https://maru.bnkode.com/@lou07409819784 maru.bnkode.com
https://git.poly.zone/lillianabehm9 https://git.poly.zone/lillianabehm9
http://gitea.danongshu.cn/joycelynritchi http://gitea.danongshu.cn/
https://git.anacsoft.com/davidat099012 git.anacsoft.com
https://git.van-peeren.de/gabrielq407207 git.van-peeren.de
https://pilowtalks.com/@shaundillon362 https://pilowtalks.com/@shaundillon362
https://www.lizyum.com/@melvinawerfel lizyum.com
https://git.berfen.com/valentinpts301 git.berfen.com
https://asixmusik.com/rhodapickrell0 https://asixmusik.com/rhodapickrell0
https://gogs.kakaranet.com/salvatorebuckn gogs.kakaranet.com
https://ophiuchus.wiki/simonepogue93 https://ophiuchus.wiki/
https://flixwood.com/@gretta2901997?page=about flixwood.com
https://geniusactionblueprint.com/@steffenmadsen4?page=about https://geniusactionblueprint.com
https://gitea.ashcloud.com/julieta96u4788 gitea.ashcloud.com
https://git.zimerguz.net/linniebirkbeck git.zimerguz.net
https://duncanvilledash.com/@hattiecruicksh?page=about https://duncanvilledash.com
https://git2.huai-yun.com/colletter80282 https://git2.huai-yun.com/colletter80282
http://git.hnits360.com/johnpsk1429614 git.hnits360.com
https://git.crudelis.kr/luellaerr7257 https://git.crudelis.kr/
https://git.lolpro11.me/ignacioogilvie https://git.lolpro11.me/ignacioogilvie
https://music.growverse.net/deidrecarvosso music.growverse.net
https://tintinger.org/omawise6649945 https://tintinger.org/omawise6649945
https://git.inscloudtech.com/tricia18385700 git.inscloudtech.com
https://git.berfen.com/sylvester40y23 https://git.berfen.com/sylvester40y23
https://date.ainfinity.com.br/@codyfults07906 https://date.ainfinity.com.br/@codyfults07906
https://www.k0ki-dev.de/lashundamenge https://www.k0ki-dev.de/
https://git.z1.mk/mamieparsons66 git.z1.mk
http://begild.top:8418/lucioshackleto http://begild.top/
https://dating.hyesearch.com/@burtonmcguirk dating.hyesearch.com
https://playxtream.com/@dieterw639963?page=about playxtream.com
https://git.temporaryname.org/tanishathorpe2 git.temporaryname.org
https://tur.my/nicolasspeckma tur.my
https://gitea.abra.me/carmamullins56 gitea.abra.me
https://dev.dhf.icu/marilynjiron43 https://dev.dhf.icu/marilynjiron43
https://git.snowcloak-sync.com/kian46y1603439 git.snowcloak-sync.com
https://git.sgap.uk/josefad9099659 https://git.sgap.uk
https://git.becks-web.de/cyrusmullens37 https://git.becks-web.de/cyrusmullens37
https://git.galaxylabs.ca/margosebastian https://git.galaxylabs.ca
https://git.obo.cash/mavisyxj56529 git.obo.cash
https://git.saidomar.fr/lizacato50296 git.saidomar.fr
https://easyconnect.fun/@svafreda351888 https://easyconnect.fun/@svafreda351888
https://vila.go.ro/sybiltwx755268 https://vila.go.ro/
https://git.auwiesen2.de/dellakuntz300 git.auwiesen2.de
https://qarisound.com/franciscostled qarisound.com
https://airplayradio.com/alejandrobergi airplayradio.com
https://easyconnect.fun/@svafreda351888 https://easyconnect.fun/
https://www.simpra.org:3000/ramiromortimer www.simpra.org
https://git.wisder.net/buddycosby7738 https://git.wisder.net/
https://virnal.com/@felishablanks6?page=about virnal.com
https://surily.in/changcantrell4 surily.in
https://git.lolpro11.me/ignacioogilvie git.lolpro11.me
http://dev-gitlab.dev.sww.com.cn/jodycable52552 dev-gitlab.dev.sww.com.cn
https://rearch.engineer/toniagilliland rearch.engineer
https://git.limework.net/eulaliavanotte https://git.limework.net/
https://www.fastmarry.com/@dannreinke560 www.fastmarry.com
https://circassianweb.com/video/@erwintaulbee36?page=about circassianweb.com
https://homeablazebyhispresence.dennmachinery.com/@delorisgreene?page=about https://homeablazebyhispresence.dennmachinery.com/@delorisgreene?page=about
https://geniusactionblueprint.com/@megannacht795?page=about geniusactionblueprint.com
https://mp3diary.com/sabinebiscoe31 https://mp3diary.com/sabinebiscoe31
http://tigerpi.cn:3000/emiliaearls545 tigerpi.cn
http://www.feiko.cn:3300/arnulfolett909 www.feiko.cn
https://tv.sparktv.net/@cheriyuranigh3?page=about tv.sparktv.net
https://www.lizyum.com/@theresemansom3 www.lizyum.com
http://git.youkehulian.cn/jamalbinns5857 git.youkehulian.cn
https://percyroberts.com/lucilefield129 https://percyroberts.com/
https://git.atomos.io/priscillanicke git.atomos.io
https://indianmixedwrestling.com/@lois32z287081?page=about https://indianmixedwrestling.com
https://heartbeatdigital.cn/violetwaters21 heartbeatdigital.cn
http://www.doyahome.cn:2045/beezoe09324022 http://www.doyahome.cn:2045/beezoe09324022
http://guishenking.cloud:3000/garnetcropper4 guishenking.cloud
http://gitea.mintelcn.com/rhondalander97 gitea.mintelcn.com
https://git.autotion.net/albertinacoone git.autotion.net
https://gitea.ontoast.uk/nellylindgren gitea.ontoast.uk
https://git.cloud.leonclassroom.com/tommyvanderbil git.cloud.leonclassroom.com
https://git.erdei-dev.hu/antjenaranjo9 git.erdei-dev.hu
https://www.k0ki-dev.de/lanny37n842854 https://www.k0ki-dev.de/
https://adufoshi.com/edwinakissner adufoshi.com
https://gitea.fuluzhanggui.com:99/elizaweiser667 gitea.fuluzhanggui.com
https://www.musicsound.ca/winonam947411 www.musicsound.ca
https://git.rbsx.de/shantellcoz979 git.rbsx.de
http://repo.magicbane.com/sondrasiddons repo.magicbane.com
https://devkona.net/faustorosenste devkona.net
https://luvwing.com/@pilarabdul225 luvwing.com
https://git.agri-sys.com/stevebou106219 git.agri-sys.com
https://git.smartenergi.org/myraroddy3733 git.smartenergi.org
https://jovita.com/grant72r244984 jovita.com
https://gogs.kakaranet.com/salvatorebuckn https://gogs.kakaranet.com/salvatorebuckn
https://www.k0ki-dev.de/andres9706975 www.k0ki-dev.de
https://git.berfen.com/oliviahilliard https://git.berfen.com/
https://tintinger.org/harlancrandall tintinger.org
https://git.malls.iformall.com/monikablount5 git.malls.iformall.com
https://datingmywish.com/@maurinehaddock datingmywish.com
https://camtalking.com/@donnybeaurepai camtalking.com
https://git.limework.net/fredmanley6377 git.limework.net
https://datemyfamily.tv/@teresitaappler datemyfamily.tv
https://git.rec4box.com/grettacastanon git.rec4box.com
https://git.yuhong.com.cn/freddieosgood https://git.yuhong.com.cn/freddieosgood
https://profmustafa.com/@jeanettclaflin?page=about profmustafa.com
https://afritunes.net/robertapearl72 https://afritunes.net/
https://ngoma.app/ashlyvillegas ngoma.app
https://aipod.app/onitasouza193 aipod.app
https://startuptube.xyz/@cathryncalwell?page=about https://startuptube.xyz
https://katibemaraty.com/@darringiorza68?page=about https://katibemaraty.com/@darringiorza68?page=about
https://jovita.com/denism22192088 jovita.com
https://aws-poc.xpresso.ai/gitlab/tommiehook9449 aws-poc.xpresso.ai
http://newslabx.csie.ntu.edu.tw:3000/angelinaiyi911 newslabx.csie.ntu.edu.tw
http://www.huastech.com.cn:81/vaniaachen421 www.huastech.com.cn
http://code.sikey.com.cn/kristopherrame http://code.sikey.com.cn/
https://karr83.world/read-blog/2720_hgh-wirkung-risiken-und-einsatz-von-somatropin.html karr83.world
https://omegat.dmu-medical.de/caitlynyounger omegat.dmu-medical.de
http://tigerpi.cn:3000/augustinagarde tigerpi.cn
https://gitea.thanh0x.com/mirtarister641 https://gitea.thanh0x.com/mirtarister641
https://www.simpra.org:3000/jeannawitte092 www.simpra.org
https://deltasongs.com/francescadunro deltasongs.com
https://git.vce.de/katharina25027 https://git.vce.de
https://git.gonstack.com/carolea6565618/carole2010/-/issues/1 https://git.gonstack.com/carolea6565618/carole2010/-/issues/1
https://www.youtoonetwork.com/youtootube/@rueben35755106?page=about www.youtoonetwork.com
https://gitlab.ngser.com/patrickt117895 gitlab.ngser.com
https://git.mklpiening.de/hudsonocampo5 git.mklpiening.de
https://git.ecq.jp/veroniqueq6354 git.ecq.jp
https://mockway.cpolar.top/carloeasterlin mockway.cpolar.top
https://nelgit.nelpi.co.uk/quincy81812035 nelgit.nelpi.co.uk
https://git.mista.ru/irving77d60770 git.mista.ru
https://git.karma-riuk.com/erik28s052784 https://git.karma-riuk.com
https://www.lizyum.com/@veroniquegalin https://www.lizyum.com/@veroniquegalin
https://motion-nation.com/read-blog/26_wachstumshormone-hgh-kaufen-legal-somatropin-bestellen.html motion-nation.com
https://nonstopvn.net/@kelvinconover?page=about https://nonstopvn.net/@kelvinconover?page=about
https://clients.git.marv.pw/myrtletrudel60/9685214/wiki/Wachstumshormon%253A+Wirkung+und+Regulation clients.git.marv.pw
https://git.homains.org/janellmustar8 https://git.homains.org/janellmustar8
https://git.ncue.net/stepaniesundbe git.ncue.net
https://isugar-dating.com/@robert70c28786 isugar-dating.com
https://movieplays.net/@kendrahartigan?page=about movieplays.net
https://funnyutube.com/@justinacady502?page=about https://funnyutube.com/@justinacady502?page=about
https://icas.life/read-blog/917_glandula-online-wachstumshormonmangel-bei-erwachsenen.html icas.life
https://healthbookbd.com/read-blog/18227_staatsunabhangige-theologische-hochschule-basel.html healthbookbd.com
https://bluebirdmusic.in/@delores27m5046?page=about https://bluebirdmusic.in/@delores27m5046?page=about
https://lius.familyds.org:3000/efraincaskey22 https://lius.familyds.org/
https://jobdoot.com/companies/sermorelin-ipamorelin-the-peptide-blend-men-are-talking-about/ jobdoot.com
https://jobs.jaylock-ph.com/companies/sermorelin-ipamorelin-the-haven/ sermorelin/ipamorelin blend side
effects
https://getshired.com/employer/ipamorelin-vs-sermorelin-key-distinctions-and-advantages/ ipamorelin and sermorelin suppliers
https://urlb.link/lashawnrodway1 sermorelin-ipamorelin-cjc1295 dosage
http://www.annunciogratis.net/author/jordanpaqui ipamorelin sermorelin acetate
http://08.ink/elouiseykx7422 http://08.ink/elouiseykx7422
https://tap.ngo/garfieldoquend valley.md
https://joecrew.co/employer/sermorelin-vs-ipamorelin-a-comparison-of-growth-hormone-secretagogues/ https://joecrew.co
https://jobbridge4you.com/employer/unveiling-the-power-of-a-trehalose-based-blend-tesamorelin-ipamorelin-and-cjc-1295-combined-for-optimal-results/ is sermorelin or ipamorelin better
https://findmeacaregiver.com/employer/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ what's better
ipamorelin or sermorelin
https://1ajobs.ch/employer/ipamorelin-vs.-sermorelin:-which-growth-hormone-secretagogue-is-right-for-you/?/ sermorelin ipamorelin anti aging
https://dbitly.com/maryjohandt74 sermorelin-ipamorelin-cjc
1295 dosage
https://jobs.sudburychamber.ca/employer/ipamorelin-vs-sermorelin-key-differences-explained/ valley.md
https://prel.ink/julissa63x2558 sermorelin ipamorelin anti
aging treatment
https://shige.77ga.me/home.php?mod=space&uid=199938&do=profile&from=space ipamorelin vs tesamorelin vs
sermorelin
https://secretmessage8.site/donnellbryce40 valley.md
https://medicallystaffing.com/employer/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ https://medicallystaffing.com/
https://links.trafficninja.net/candelaria sermorelin/ipamorelin blend
side effects
https://jobs.foodtechconnect.com/companies/sermorelin-ipamorelin-blended-injection-made-in-the-usa-for-sale/ jobs.foodtechconnect.com
https://academicbard.com/employer/sermorelin-vs-cjc-1295-and-ipamorelin-which-peptide-therapy-is-best-for-hgh-optimization/ sermorelin-ipamorelin-cjc1295 oral
https://timviec24h.com.vn/companies/top-peptide-stack-picks-for-2025-the-definitive-guide/ valley.md
https://demanza.com/employer/sermorelin-vs-ipamorelin-choosing-the-right-growth-hormone-peptide-for-your-needs/ valley.md
https://euvisajobs.com/employer/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ https://euvisajobs.com/
https://qra.se/gwenfenbury05 taking ipamorelin and sermorelin
https://elclasificadomx.com/author/jasminevji1/ valley.md
https://oromiajobs.com/profile/shannaykv7406 ipamorelin vs
sermorelin steroids
https://kaykarbar.com/companies/tesamorelin-vs-ipamorelin-cjc-1295-head-to-head-review/ sermorelin ipamorelin blend
https://jobsrific.com/employer/sermorelin-dosing-applications-and-comparative-review/ sermorelin / ipamorelin
https://remotelytech.com/employer/125985/top-peptide-stacks-to-try-in-2025-the-definitive-guide/ sermorelin ipamorelin injection
https://skillproper.com/employer/ipamorelin-vs-sermorelin-a-detailed-side-by-side-review-and-practical-handbook/ https://skillproper.com/employer/ipamorelin-vs-sermorelin-a-detailed-side-by-side-review-and-practical-handbook/
https://jobs1.unifze.com/employer/ipamorelin-vs-sermorelin-which-growth-hormone-peptide-is-superior/ sermorelin ipamorelin program
https://gratisafhalen.be/author/jefferywomb/ valley.md
https://www.complete-jobs.co.uk/employer/optimizing-dosages-for-a-sermorelin-ipamorelin-combination peg-mg ipamorelin and sermorelin series dosage
http://www.annunciogratis.net/author/jordanpaqui http://www.annunciogratis.net/author/jordanpaqui
https://rsh-recruitment.nl/employer/exploring-the-effects-of-a-sermorelin-ipamorelin-combination-on-growth-hormone-regulation/ buy sermorelin & ipamorelin
http://zenithgrs.com/employer/is-the-sermorelin-ipamorelin-stack-truly-powerful/ sermorelin ipamorelin blend for sale
https://syurl.com/chana357978238 valley.md
https://tictaccollection.life/melodeefender tictaccollection.life
https://tinijob.com/companies/synergistic-treatment-combining-sermorelin-and-ipamorelin/ tinijob.com
https://www.mazafakas.com/user/profile/7576957 sermorelin vs ipamorelin cjc
1295
https://www.globalscaffolders.com/employer/ipamorelin-vs.-tesamorelin,-sermorelin,-cjc-1295,-and-other-top-peptides:-a-comparative-overview/ sermorelin & ipamorelin for sale
https://vagas.grupooportunityrh.com.br/employer/ipamorelin-vs-sermorelin-an-in-depth-comparison-and-practical-guide/ sermorelin &
ipamorelin blend
https://prel.ink/julissa63x2558 sermorelin ipamorelin blend peptide for men
https://reeltalent.gr/employer/sermorelin-vs-ipamorelin-choosing-the-right-peptide-for-your-needs/ ipamorelin vs
sermorelin vs tesamorelin
https://cvcentrum.eu/companies/tesamorelin-vs-sermorelin-vs-ipamorelin-a-comparative-review-of-current-research/ sermorelin and
ipamorelin stack
https://volunteeri.com/companies/ipamorelin-vs-cjc-1295-which-peptide-wins/ cjc/sermorelin/ipamorelin
https://primestaff.ca/employer/ipamorelin-vs-sermorelin-choosing-the-best-option-for-your-needs/ valley.md
https://careeramaze.com/employer/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-stimulator-for-your-goals/ ipamorelin vs sermorelin reddit
https://sosi.al/micheleodohert peg-mg ipamorelin and sermorelin series dosage
https://pagemelon.com/burtonmccu valley.md
https://flamingo.onl/fnekayleig ipamorelin acetate/sermorelin
https://gotech.peep.company/shauntedeen999 ipamorelin sermorelin injections
http://excelrenforcement.com/companies/ipamorelin-vs-sermorelin-deciding-which-growth-hormone-peptide-wins/ sermorelin or ipamorelin
https://allsolution.xyz/employer/mixing-sermorelin-and-ipamorelin-is-it-safe/ https://allsolution.xyz/employer/mixing-sermorelin-and-ipamorelin-is-it-safe
https://medicallystaffing.com/employer/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ which is better sermorelin or ipamorelin
https://nextalentpartners.com/employer/ipamorelin-a-comprehensive-look-at-before-and-after-results-by-tulsi/ sermorelin ipamorelin before and after
https://atlashrsolutions.com/employer/tesamorelin-vs-sermorelin-which-peptide-drives-fat-reduction-and-muscle-recovery/ ipamorelin vs tesamorelin vs sermorelin
https://www.sitiosbolivia.com/author/tillyg5083/ valley.md
http://www.jobteck.co.in/companies/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ valley.md
https://izibiz.pl/companies/ipamorelin-vs-sermorelin-key-differences-you-should-know/ https://izibiz.pl
https://parkerstewart.ie/employer/ipamorelin-vs.-sermorelin:-deciding-the-superior-growth-hormone-peptide/ ipamorelin and sermorelin together reddit
https://handitalents.com/employer/sermorelin-vs-cjc-1295-ipamorelin-choosing-the-right-growth-hormone-peptide-for-you/ sermorelin / ipamorelin / cjc1295 500/250/100mcg rdt
https://cleverklub.ru/chastityoflahe sermorelin-ipamorelin-cjc 1295 for sale
https://jobdoot.com/companies/sermorelin-ipamorelin-the-peptide-blend-men-are-talking-about/ cjc 1295 ipamorelin vs sermorelin reddit
https://qr.nub-1.com/janellloxton80 sermorelin ipamorelin cjc 1295
https://jobs1.unifze.com/employer/ipamorelin-vs-sermorelin-which-growth-hormone-peptide-is-superior/ sermorelin ipamorelin for sale
https://www.sitiosbolivia.com/author/tillyg5083/ sermorelin vs cjc
1295 ipamorelin
https://www.pakgovtnaukri.pk/companies/peptide-stacking-myth-vs-reality/ valley.md
https://www.belizetalent.com/employer/optimal-dosing-of-ipamorelin-and-sermorelin/ sermorelin ipamorelin cjc1295
https://iratechsolutions.com/employer/mixing-sermorelin-and-ipamorelin-is-it-possible/ taking ipamorelin and sermorelin
https://www.belizetalent.com/employer/optimal-dosing-of-ipamorelin-and-sermorelin/ sermorelin/ipamorelin/theanine
https://klm9.net/employer/sermorelin-vs-ipamorelin-a-side-by-side-look-at-anti-aging-peptides/ sermorelin/ipamorelin travel pens
https://a.leanwo.com:3000/leilanijiminez a.leanwo.com
https://bcstaffing.co/employer/693122/all-you-wish-to-find-out-about-anavar-and-check-cycles https://bcstaffing.co/employer/693122/all-you-wish-to-find-out-about-anavar-and-check-cycles
https://mp3diary.com/floyhammett136 mp3diary.com
https://repos.ubtob.net/nonaperry8117/nona2008/wiki/Anavar+For+Ladies+Benefits%252C+Dosage%252C+Side+Effects+%2526+Safe+Use+Guide repos.ubtob.net
https://ftwjobfinder.com/companies/anavar-for-girls-advantages-risks-and-what-you-need-to-know/ ftwjobfinder.com
https://zenfilm.solutions/lesli793707852 zenfilm.solutions
https://fyahtrak.com/yukikosharwood fyahtrak.com
https://utelectra.com/berryh78860975 utelectra.com
http://gitlab.alpaedu.co.kr:8000/gertieloe71980 gitlab.alpaedu.co.kr
http://volleypedia.org/index.php?qa=user&qa_1=pajamaray7 volleypedia.org
https://gogs.dev.dazesoft.cn/kristinerowley https://gogs.dev.dazesoft.cn/
https://ai.florist/read-blog/70577_anavar-solely-6-weeks-75-mg-ed-outcomes-with-footage.html ai.florist
http://www.tangjia7.com:8901/marisagoethe18 http://www.tangjia7.com:8901/marisagoethe18
https://qimley.com/@lavinamcconach https://qimley.com/
https://git.getmind.cn/evonnemccranie git.getmind.cn
https://lovewiki.faith/wiki/Take_A_Look_At_And_Tren_Cycle_Dosage_Novices_Trenbolone_Stack lovewiki.faith
http://lamsn.bigbuk.com/home.php?mod=space&uid=1457338 http://lamsn.bigbuk.com
https://www.hirelium.com/employer/anavar-for-women-what-users-have-to-know/ https://www.hirelium.com/
https://link.1hut.ru/zsmgordon92774 link.1hut.ru
http://www.okaywan.com/home.php?mod=space&uid=714912 http://www.okaywan.com/home.php?mod=space&uid=714912
http://git.fast-fun.cn:92/jennymacartney git.fast-fun.cn
https://queryforjob.com/employer/15-best-steroids-before-and-after-photos/ queryforjob.com
https://booz.live//@marcellasigmon?page=about booz.live
https://sound.gatzone.com/lanoragfw59732 sound.gatzone.com
https://quickbio.click/miguelhayter07 quickbio.click
https://agoo.focused-solution.com/read-blog/1336_eight-steroids-before-and-after-image-and-results-bodybuilding-weblog.html agoo.focused-solution.com
https://maps.google.mw/url?q=https://dev-members.writeappreviews.com/employer/anavar-in-2025-dosage-guide-benefits-and-potential-risks/ https://maps.google.mw
https://talkkro.com/read-blog/1699_anavar-steroid-cycle-dosage-unwanted-facet-effects-anavar-for.html talkkro.com
https://hekus.pl/gogs/albertoarledge/where-can-i-buy-anavar-steroid9436/wiki/Anavar+Earlier+Than+And+After+Female%253A+Inspiring+Transformations https://hekus.pl/gogs/albertoarledge/where-can-i-buy-anavar-steroid9436/wiki/Anavar Earlier Than And After Female%3A Inspiring
Transformations
https://uichin.net/ui/home.php?mod=space&uid=2162192 https://uichin.net/ui/home.php?mod=space&uid=2162192
https://git.aelhost.com/wilbertfbz3347/online9398/wiki/Anavar-Cycle-Earlier-Than-And-After%3A-Transformations-And-Outcomes git.aelhost.com
https://sistemagent.com:8081/monica11717180 https://sistemagent.com:8081/monica11717180
https://git.9ig.com/candelariahoef git.9ig.com
https://dosthi.co.in/@dino9110100773 https://dosthi.co.in
https://gamingjobs360.com/employer/before-and-after-steroids-10-transformations/ gamingjobs360.com
https://islamyaat.com/@lukebarraza417?page=about islamyaat.com
http://gogs.cect360.com/genniehoar3356/9429906/wiki/Anavar+Earlier+Than+And+After%253A+Transformations+And+Insights gogs.cect360.com
https://impulsame.net/florencedu impulsame.net
https://www.superphage.org/rhondafoust766 www.superphage.org
https://feelhospitality.com/employer/anavar-earlier-than-and-after-what-to-anticipate-from-this-well-liked-efficiency-enhancer/ https://feelhospitality.com/employer/anavar-earlier-than-and-after-what-to-anticipate-from-this-well-liked-efficiency-enhancer
https://git.poly.zone/kenrapp921672 git.poly.zone
https://postyourworld.com/@phillipcroll31?page=about https://postyourworld.com/@phillipcroll31?page=about
http://excelrenforcement.com/companies/anavar-for-women-what-users-must-know/ http://excelrenforcement.com/companies/anavar-for-women-what-users-must-know
https://musicplayer.hu/roxanna091922 https://musicplayer.hu/
https://contact-us.my/napoleon17t936 contact-us.my
https://newsflip.in/@lukascarls2244?page=about https://newsflip.in/@lukascarls2244?page=about
https://lab.nltvc.com/franxlo2647958/where-to-buy-anavar-canada3856/-/issues/1 https://lab.nltvc.com/franxlo2647958/where-to-buy-anavar-canada3856/-/issues/1
https://heheshangwu.com/space-uid-698179.html heheshangwu.com
https://ngnbrand.com/jessika6431376 ngnbrand.com
https://talentbridj.com/employer/anavar-with-trt-dose-cycle-and-stack/ talentbridj.com
https://images.google.bi/url?q=https://git.rikkei.edu.vn/gabriellagodin/7139019/-/issues/1 images.google.bi
https://short.vird.co/reganjoslyn61 short.vird.co
https://www.refermee.com/companies/anavar-cycle-key-data-and-frequently-requested-questions/ www.refermee.com
https://promovafacil.com.br/user/profile/439542 https://promovafacil.com.br/user/profile/439542
https://www.google.ci/url?q=https://gitea.cs.pollub.pl/claireo4299685 www.google.ci
https://dev.yayprint.com/anavar-only-earlier-than-and-after-solo-cycle-transformations/ https://dev.yayprint.com/anavar-only-earlier-than-and-after-solo-cycle-transformations/
http://hualiyun.cc:3568/garretttaubman/9379where-can-i-buy-anavar-steroid/wiki/39+Anavar+Cycle+Results+That+Dissolve+Fats%252C+Increase+Strength+And+Harden+Your+Physique+Articles+And+Blog hualiyun.cc
https://md.darmstadt.ccc.de/VinJPIOsTW2Im8oE4rCEpg/ md.darmstadt.ccc.de
https://git.powerdata.dk/johniestrout0 git.powerdata.dk
https://renbrook.co.uk/employer/8-steroids-before-and-after-picture-and-results-bodybuilding-weblog/ https://renbrook.co.uk
https://tiny.enajam.com/kelvinmatthews tiny.enajam.com
https://pingdup.com/read-blog/5191_anavar-for-girls-what-users-need-to-know.html pingdup.com
https://git.scene.to/samuelcoward07 git.scene.to
https://www.wejob.info/employer/39-anavar-cycle-outcomes-that-dissolve-fats-increase-strength-and-harden-your-physique-articles-and-weblog/ https://www.wejob.info
https://theprome.com/read-blog/42012_anavar-review-side-effects-dosage-ends-in-2025.html https://theprome.com
https://docs.juze-cr.de/2VmSe2nXTQC0ZK4CUxNM-w/ https://docs.juze-cr.de
https://www.xiuwushidai.com/home.php?mod=space&uid=2390742 https://www.xiuwushidai.com/home.php?mod=space&uid=2390742
https://gitea.potatox.net/lupitaglasgow9 https://gitea.potatox.net/lupitaglasgow9
https://emploi-securite.com/societes/anavar-oxandrolone-advantages-unwanted-aspect-effects-dosage-and-extra/ https://emploi-securite.com/societes/anavar-oxandrolone-advantages-unwanted-aspect-effects-dosage-and-extra/
https://simapodcast.co.ls/@vickeykahn6640?page=about https://simapodcast.co.ls
https://git.westeros.fr/gracielakifer/4302where-can-i-buy-anavar/wiki/Anavar+Facet+Effects%3F git.westeros.fr
http://iegygc.com/home.php?mod=space&uid=126864 iegygc.com
https://git.simbarbet.com/npbsuzanna1233 https://git.simbarbet.com
https://jobs.atlanticconcierge-gy.com/employer/anavar-solely-6-weeks-seventy-five-mg-ed-results-with-photos/ jobs.atlanticconcierge-gy.com
https://cuttify.io/mariony042115 https://cuttify.io
http://www.jinritongbai.com/home.php?mod=space&uid=1533392 www.jinritongbai.com
https://volunteering.ishayoga.eu/employer/anavar-evaluation-side-effects-dosage-leads-to-2025/ volunteering.ishayoga.eu
https://git.einverne.info/carltonselwyn6 https://git.einverne.info/carltonselwyn6
https://posao.zumm.info/employer/4-week-anavar-before-and-after-female-understanding-the-science-behind-the-outcomes/ https://posao.zumm.info
https://kota.lk/jesuslatour40 https://kota.lk/
https://fanajobs.com/profile/cruzz892471715 fanajobs.com
https://rentry.co/38003-anavar-cycle-important-data-for-optimal-outcomes--utilization rentry.co
https://git.ism-dev.net/carissawinslow https://git.ism-dev.net
https://645123.com/@vspbonnie81021?page=about 645123.com
https://mupf.me/aureliasorell mupf.me
http://dev.baidubaoche.com/geoffreybernay http://dev.baidubaoche.com/geoffreybernay
http://famedoot.in/read-blog/94907_anavar-cycle-before-and-after-transformations-and-outcomes.html famedoot.in
https://git.tordarus.net/franciscowilbu git.tordarus.net
https://git.migoooo.com/betsey63b59700 git.migoooo.com
https://dating.igbopeople.org/@jennihiggins2 https://dating.igbopeople.org
https://employme.app/employer/when-to-take-anavar-before-exercise-drive-musculation/ employme.app
https://dev-members.writeappreviews.com/employer/anavar-guide-what-you-should-know-about-oxandrolone-for-medical-and-fitness-objectives/ dev-members.writeappreviews.com
https://gitlab.cranecloud.io/tammiestory257 https://gitlab.cranecloud.io/tammiestory257
https://tv.sparktv.net/@mauricioedouar?page=about tv.sparktv.net
https://eliteyachtsclub.com/employer/anavar-outcomes-complete-timeline-week-by-week-how-lengthy-to-see-a-change/ eliteyachtsclub.com
https://xn--ciqaa.online/felicahoffman8 ciqaa.online
https://i-medconsults.com/companies/anavar-earlier-than-and-after-transformations-and-insights/ i-medconsults.com
https://www.soundofrecovery.org/terasteiner641 https://www.soundofrecovery.org/terasteiner641
https://linktree.biz/brittbattl https://linktree.biz
https://krtie.co/pearlineleichh krtie.co
https://clcs.site/marquitasacco clcs.site
https://git.xxzz.space/mohammednunes/buying-anavar2009/wiki/Anavar-Cycle%3A-A-Comprehensive-Guide-For-Beginners-And-Consultants git.xxzz.space
https://www.middleeasthire.com/employer/high-10-anadrol-cycles-for-bulking-and-slicing/ https://www.middleeasthire.com
https://gogs.artapp.cn/dontecalloway3 gogs.artapp.cn
https://nujob.ch/companies/anavar-cycle-vital-data-for-optimum-results-utilization/ nujob.ch
https://malucarestaurant.ca/vern96p777884 https://malucarestaurant.ca/vern96p777884
https://amcompany.ir/read-blog/572_just-for-anavar-customers-my-earlier-than-amp-after-pictures.html amcompany.ir
https://vcs.connecton.co.jp/isslasonya5071 vcs.connecton.co.jp
https://love63.ru/@daniel60w2722 https://love63.ru/
https://git.sleepingforest.co.uk/roccocouch6909 https://git.sleepingforest.co.uk/roccocouch6909
https://adufoshi.com/claudiasebasti https://adufoshi.com/claudiasebasti
https://dev.dhf.icu/roryholyfield0 dev.dhf.icu
https://code.openmobius.com:3001/renateewen899 code.openmobius.com
https://gitea.systemsbridge.ca/brigitteandrew gitea.systemsbridge.ca
http://gitea.shundaonetwork.com/donettebeeby00 http://gitea.shundaonetwork.com/donettebeeby00
https://platform.giftedsoulsent.com/elladougharty3 platform.giftedsoulsent.com
https://git.unglab.com/sanfordstorkey git.unglab.com
http://blueroses.top:8888/sylviatimmer09 blueroses.top
https://git.obo.cash/hollisgiven775 https://git.obo.cash/hollisgiven775
https://luvwing.com/@tobiasvanguild https://luvwing.com/@tobiasvanguild
http://git.gkcorp.com.vn:16000/mikaylan98317 git.gkcorp.com.vn
https://git.pcgf.io/marshallcausey git.pcgf.io
http://git.7doc.com.cn/marcelhyland08 http://git.7doc.com.cn/marcelhyland08
http://gitea.bettercell.synology.me:3000/kandysalomons5 gitea.bettercell.synology.me
https://git.limework.net/cathymartinovi git.limework.net
https://mystdate.com/@brendashuster5 https://mystdate.com/@brendashuster5
https://kayesbamusic.com/kyxjett8702607 https://kayesbamusic.com/
https://git.ezmuze.co.uk/chassidyanglis https://git.ezmuze.co.uk
https://kingpeter.ewsstagging.com/troybui4048101 kingpeter.ewsstagging.com
https://wiki.idealirc.org/lesterlavigne3 https://wiki.idealirc.org
https://surily.in/leiarodgers01 surily.in
https://kingpeter.ewsstagging.com/rossberkman61 kingpeter.ewsstagging.com
https://git.ides.club/clementcarone7 https://git.ides.club/clementcarone7
https://git.anacsoft.com/chasea49161756 https://git.anacsoft.com/chasea49161756
https://tippy-t.com/normangrimshaw tippy-t.com
https://gitea.sguba.de/portercamden09 https://gitea.sguba.de
http://gitea.wholelove.com.tw:3000/verlenedegotar gitea.wholelove.com.tw
http://wangchongwu.vicp.fun:3333/ottoplath7247 http://wangchongwu.vicp.fun/
https://gitnto.innovationcampus.ru/wilbertcoy6717 gitnto.innovationcampus.ru
http://zfselect.cn:3000/ieplawanna8411 zfselect.cn
https://git.anibilag.ru/chastitysells2 https://git.anibilag.ru/chastitysells2
https://matchmadeinasia.com/@wendialt854025 matchmadeinasia.com
https://wiki.idealirc.org/ilseperdue342 https://wiki.idealirc.org/ilseperdue342
https://www.chenisgod.com:3096/lucilledunkley https://www.chenisgod.com/
https://git.akarpov.ru/careymansfield https://git.akarpov.ru/careymansfield
https://saga.iao.ru:3043/sterlingnag580 https://saga.iao.ru/
https://git.vhdltool.com/kyledeason579 git.vhdltool.com
https://git.juici.ly/gfrhildegarde8 git.juici.ly
https://git.xemo-net.de/arnulfomaher2 git.xemo-net.de
https://gitea.ashcloud.com/stefanmayer82 https://gitea.ashcloud.com/stefanmayer82
https://zoucast.com/quinn402549677 zoucast.com
http://git.chilidoginteractive.com:3000/leoreiss205251 git.chilidoginteractive.com
https://git.droenska.com/kennithmuirden git.droenska.com
https://airplayradio.com/trentmcgriff3 airplayradio.com
https://www.kornerspot.com/@maritzagatehou https://www.kornerspot.com/@maritzagatehou
http://gitea.danongshu.cn/archiei9668522 gitea.danongshu.cn
https://git.noxxxx.com/johnnysladen9 git.noxxxx.com
https://www.besolife.com/@florinemccallu www.besolife.com
https://git.siin.space/charlicatalano https://git.siin.space/
https://git.lakaweb.com/pedroried25450 git.lakaweb.com
https://git-web.phomecoming.com/jeffersondown4 https://git-web.phomecoming.com
https://git.cnml.de/mckinleyabel9 https://git.cnml.de/
http://saromusic.ir/irwinsalting35 saromusic.ir
http://dgzyt.xyz:3000/sodina33461637 dgzyt.xyz
https://git.cloud.leonclassroom.com/deniceholmes11 git.cloud.leonclassroom.com
https://git.rec4box.com/lorraineable12 https://git.rec4box.com/lorraineable12
https://git.atomos.io/hattieoxenham https://git.atomos.io
https://gitea.mocup.org/erikworthy142 https://gitea.mocup.org/erikworthy142
http://git.jetplasma-oa.com/racheleburd047 http://git.jetplasma-oa.com/racheleburd047
https://git.ajattix.org/christianlim27 https://git.ajattix.org
https://fyahtrak.com/tonyatwx23366 fyahtrak.com
https://git.healthathome.com.np/julie42h107876 git.healthathome.com.np
http://gitea.danongshu.cn/kandybanfield http://gitea.danongshu.cn/
https://git.cydedu.com/rwpchase613792 https://git.cydedu.com/
https://gitea.sguba.de/chunfernandez gitea.sguba.de
https://rc.intaps.com/orville5550182 rc.intaps.com
https://git2.ujin.tech/dominickarsena git2.ujin.tech
https://git.lodis.se/kennethlarue87 https://git.lodis.se/
https://luvwing.com/@zakhaber96762 luvwing.com
https://purednacupid.com/@thelmafrodsham https://purednacupid.com/
https://git.noxxxx.com/johnnysladen9 git.noxxxx.com
http://wangchongwu.vicp.fun:3333/ottoplath7247 wangchongwu.vicp.fun
https://meeting2up.it/@rebekahsalaam https://meeting2up.it/@rebekahsalaam
http://wangchongwu.vicp.fun:3333/alejandrinakul wangchongwu.vicp.fun
https://mixtify.top/thedabeverly39 mixtify.top
https://speeddating.co.il/@lola87q966230 speeddating.co.il
https://gitea.quiztimes.nl/melissabledsoe https://gitea.quiztimes.nl
http://repo.magicbane.com/kristopher06x1 http://repo.magicbane.com/
https://zurimeet.com/@derrickmcclana zurimeet.com
https://naijasingles.net/@luisarummel057 https://naijasingles.net/
https://tippy-t.com/jimredd6771956 tippy-t.com
https://git.berfen.com/linnie32863825 https://git.berfen.com/
https://g.6tm.es/robbyn2807708 g.6tm.es
http://newslabx.csie.ntu.edu.tw:3000/jaunitarhoades http://newslabx.csie.ntu.edu.tw
https://rearch.engineer/mariansocha86 rearch.engineer
https://git.agusandelnorte.gov.ph/kayleechristia https://git.agusandelnorte.gov.ph
https://hgngit.ipdz.me/timmuirden8326 https://hgngit.ipdz.me/timmuirden8326
http://git.jetplasma-oa.com/reyesmackinlay http://git.jetplasma-oa.com/
https://love63.ru/@marlablohm9469 https://love63.ru/@marlablohm9469
https://gitea.synapsetec.cn/joycelynbachma gitea.synapsetec.cn
https://alm.pragmatismo.com.br/umkclarice216 https://alm.pragmatismo.com.br
https://gitea.coderpath.com/candicev358834 gitea.coderpath.com
https://gitea.viewdeco.cn/zeldalindquist gitea.viewdeco.cn
https://gitea.zzspider.com/justinepalazzi https://gitea.zzspider.com/
https://git.smartenergi.org/sondragatling git.smartenergi.org
https://git.the-kn.com/krystalrobledo https://git.the-kn.com/krystalrobledo
https://sound.floofbite.com/dedrafergerson https://sound.floofbite.com
https://camtalking.com/@gilbertgeyer2 camtalking.com
https://hiphopmusique.com/jamibourgeois3 https://hiphopmusique.com
https://git.gupaoedu.cn/briannebloodsw git.gupaoedu.cn
http://oa.sccehui.com:6101/stanmehler8208 oa.sccehui.com
https://sistemagent.com:8081/wilfredovigano https://sistemagent.com:8081/wilfredovigano
https://git.sleepingforest.co.uk/brandensparkma git.sleepingforest.co.uk
https://www.kornerspot.com/@maritzagatehou https://www.kornerspot.com/
http://www.mmgold.top:8103/velmarosetta8 www.mmgold.top
https://hgngit.ipdz.me/lacey01182749 hgngit.ipdz.me
https://git.meohm.ddns.net/frankbecnel87 https://git.meohm.ddns.net
https://silatdating.com/@emeliaswenson https://silatdating.com/@emeliaswenson
https://soundcashmusic.com/todlocke152642 soundcashmusic.com
https://gitea.boner.be/albertgrenier https://gitea.boner.be/albertgrenier
http://git.fbonazzi.it/margaritaalons git.fbonazzi.it
https://zm.aosenhw.com/@sidneysabella5 zm.aosenhw.com
https://www.propose.lk/@margokelson12 propose.lk
https://spinvai.com/hilarioramos88 spinvai.com
https://gitea.synapsetec.cn/joycelynbachma gitea.synapsetec.cn
https://gitea.zzspider.com/justinepalazzi gitea.zzspider.com
https://speeddating.co.il/@lola87q966230 https://speeddating.co.il/
https://loveis.app/@ftsclark16361 loveis.app
https://artbeninshow.afiganmey.com/leoboote01048 artbeninshow.afiganmey.com
https://gitea.jasonstolle.com/pojhilario1646 gitea.jasonstolle.com
https://gitlab.rails365.net/michelineelean https://gitlab.rails365.net
https://csmsound.exagopartners.com/dakotajoyner28 csmsound.exagopartners.com
https://gitea.gimmin.com/corazonmassie3 https://gitea.gimmin.com/corazonmassie3
https://code.openmobius.com:3001/dawnshang93515 code.openmobius.com
https://love63.ru/@mfepatrick4670 https://love63.ru/@mfepatrick4670
https://fyahtrak.com/leilaj57017003 fyahtrak.com
https://kayesbamusic.com/jaycorlette306 kayesbamusic.com
https://duanju.meiwang360.com/nellereyes484 duanju.meiwang360.com
http://sheyiyuan.cn:3000/sandranicolay4 sheyiyuan.cn
http://gitea.yunshanghub.com:8081/ginakaawirn55 gitea.yunshanghub.com
https://git.unglab.com/sanfordstorkey git.unglab.com
http://www.w003.cloud:8418/floridahiginbo www.w003.cloud
https://git.cnml.de/mckinleyabel9 https://git.cnml.de/mckinleyabel9
https://nuhweh.com/kaleyy9397195 nuhweh.com
https://clone-deepsound.paineldemonstrativo.com.br/carmellahedber clone-deepsound.paineldemonstrativo.com.br
https://git.xemo-net.de/marcelocallana git.xemo-net.de
https://code.openmobius.com:3001/dawnshang93515 code.openmobius.com
http://gitea.mintelcn.com/shelli76j5863 gitea.mintelcn.com
https://syq.im:2025/shaybaudin159 https://syq.im:2025/shaybaudin159
https://git.wisptales.org/alisiaconstant https://git.wisptales.org
https://git.kirasparkle.de/shanichavers24 https://git.kirasparkle.de/shanichavers24
https://gitea.dusays.com/nona939144936 gitea.dusays.com
https://datemyfamily.tv/@elsabrunton12 https://datemyfamily.tv/@elsabrunton12
https://git.camus.cat/donnelltompson git.camus.cat
https://surily.in/dorrism0469418 surily.in
https://koseongnam.com/chadwicklowers koseongnam.com
https://rc.intaps.com/laurenemaples https://rc.intaps.com/laurenemaples
https://code.luoxudong.com/byronhuntsman0 https://code.luoxudong.com/
https://aipod.app/veronicatejada aipod.app
https://gitea.quiztimes.nl/delldougherty8 gitea.quiztimes.nl
https://quickdatescript.com/@vctyasmin1642 quickdatescript.com
https://laviesound.com/cliffyuille583 laviesound.com
http://gitea.shundaonetwork.com/kelleeforro148 gitea.shundaonetwork.com
https://ophiuchus.wiki/iveybolinger4 ophiuchus.wiki
https://supardating.com/@concepcionbass supardating.com
https://git.memosnag.com/lillianwhitehe git.memosnag.com
https://loveis.app/@noeiverson0111 loveis.app
https://music.1mm.hk/eltonling7525 https://music.1mm.hk/
https://fyahtrak.com/sungartis41775 https://fyahtrak.com/sungartis41775
https://www.appleradish.org/emilhnq3665241 www.appleradish.org
https://repo.apps.odatahub.net/orlandowardell https://repo.apps.odatahub.net
http://www.huastech.com.cn:81/elisephillip2 http://www.huastech.com.cn:81/elisephillip2
https://git.hantify.ru/melindathrelke git.hantify.ru
https://gitea.coderpath.com/candicev358834 gitea.coderpath.com
https://gitea.mocup.org/lea89r8029284 gitea.mocup.org
http://blueroses.top:8888/sylviatimmer09 http://blueroses.top:8888/sylviatimmer09
https://smusic.sochey.com/sherrystillman https://smusic.sochey.com
https://selfloveaffirmations.net/@calebaml265642 selfloveaffirmations.net
https://axc.duckdns.org:8091/felicitas9804 axc.duckdns.org
https://clone-deepsound.paineldemonstrativo.com.br/dorrisoxenham clone-deepsound.paineldemonstrativo.com.br
https://git.dihe.moe/patkruttschnit git.dihe.moe
https://bantoomusic.com/leonelchipper https://bantoomusic.com/
https://gitea.dusays.com/dolliewaechter https://gitea.dusays.com
https://afromonsta.com/shaunteshockey afromonsta.com
https://worldclassdjs.com/ernestinecrume worldclassdjs.com
https://finalresult.buzz/jacks43189840 finalresult.buzz
http://tools.refinecolor.com/kittyheard1328 tools.refinecolor.com
https://gitea.johannes-hegele.de/elenaburford0 https://gitea.johannes-hegele.de/elenaburford0
https://10xhire.io/employer/us-made-comparison:-sermorelin-vs.-ipamorelin-vs.-tesamorelin-benefits/ valley.md
https://careers.cblsolutions.com/employer/the-core-of-the-web/ sermorelin ipamorelin results
https://analyticsjobs.in/jobs/companies/ipamorelin-cjc-1295-how-this-peptide-duo-boosts-growth-and-recovery/ ipamorelin vs sermorelin comparison
http://progress.matorres.com.br/index.php?action=profile;u=38593 sermorelin + ipamorelin blend for
sale
http://forum.emrpg.com/home.php?mod=space&uid=1413869&do=profile what is better sermorelin or ipamorelin
https://rentry.co/65438-synergistic-peptide-pairing-sermorelin-meets-ipamorelin-in-dual-therapy-regimens sermorelin and ipamorelin stack
https://career-hunters.com/employer/sermorelin-dose-guide-key-information-for-patients/ sermorelin-ipamorelin-cjc1295 pills
https://adremcareers.com/employer/ipamorelin-cjc-1295-results-before-and-after/ sermorelin ipamorelin blend for sale
https://allbio.link/oskstuart0 valley.md
https://spin.org.pk/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ valley.md
https://recrutement.fanavenue.com/companies/mixing-sermorelin-and-ipamorelin-is-it-possible/ sermorelin/ipamorelin blend reviews
https://hmljobs.com/employer/1709/top-peptide-stack-picks-of-2025-your-comprehensive-guide sermorelin vs cjc ipamorelin
https://rater.in/companies/the-core-of-the-web/ sermorelin ipamorelin log
https://www.dynamicviewpoint.co.uk/employer/sermorelin-and-ipamorelin-a-potent-peptide-stack/ what is the difference
between sermorelin and ipamorelin
https://yojob.hk/employer/sermorelin-vs-cjc-1295-ipamorelin-choosing-the-right-growth-hormone-peptide-for-you/ yojob.hk
https://yaseend6.sg-host.com/phillippestrel yaseend6.sg-host.com
https://gotech.peep.company/bonniebadham7 valley.md
https://teachanycountry.com/employer/ipamorelin-vs-sermorelin-key-differences-and-advantages/ https://teachanycountry.com
http://www.annunciogratis.net/author/lelamoowatt sermorelin and
ipamorelin stack dosage
https://portalwe.net/employer/sermorelin-and-ipamorelin-blend-optimal-dosage-guide/ buy sermorelin & ipamorelin
https://www.cbl.aero/employer/ipamorelin-vs-sermorelin-the-key-differences-you-should-know/ sermorelin-ipamorelin-cjc1295 buy
https://nxtgencorp.in/employer/tesamorelin-vs-ipamorelin-cjc-1295-a-side-by-side-review/ sermorelin and
ipamorelin price
https://ejstaffing.ca/companies/sermorelin-vs-cjc-1295-how-to-pick-the-right-peptide-therapy-for-you/ what is the doseage for 5mg sermorelin 5mg ipamorelin
https://timviec24h.com.vn/companies/sermorelin-vs-cjc-1295-a-side-by-side-look-at-growth-hormone-releasing-peptides/ sermorelin-ipamorelin-cjc1295 pills
http://www.rohitab.com/discuss/user/3197366-nedtarr257/ oral efficacy of sermorelin ipamorelin cjc 1295
https://career.cihpng.org/companies/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ https://career.cihpng.org
https://career.abuissa.com/employer/sermorelin-vs-cjc-1295-vs-ipamorelin-a-comparative-overview/ sermorelin ipamorelin blend 10mg dosage
https://2workinoz.com.au/employers/sermorelin-ipamorelin-combo-optimal-dosing-and-expected-benefits-guide/?-ipamorelin-combo%3A-optimal-dosing-and-expected-benefits-guide%2F cjc-1295
and ipamorelin vs sermorelin
https://rentry.co/65438-synergistic-peptide-pairing-sermorelin-meets-ipamorelin-in-dual-therapy-regimens cjc
ipamorelin vs sermorelin
https://istihdam.efeler.bel.tr/employer/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-peptide-for-you/ sermorelin and ipamorelin stack dosage
https://jobsleed.com/companies/sermorelin-vs-ipamorelin-picking-the-prime-peptide-for-vitality-aesthetic-and-regenerative-care/ can you stack sermorelin with cjc 1295 ipamorelin
https://smarthr.com.hk/Companies/ipamorelin-applications-and-advantages-how-it-works-recommended-doses-and-potential-adverse-effects/ is
it safe combine sermorelin with cdc/ipamorelin together
https://analyticsjobs.in/jobs/companies/ipamorelin-vs-sermorelin-key-differences-you-should-know/ sermorelin ipamorelin blend
peptide for sale
https://bcstaffing.co/employer/701902/ipamorelin-cjc-1295-a-powerful-synergy-for-peak-performance sermorelin w
ipamorelin
https://careers.cblsolutions.com/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ sermorelin ipamorelin and cjc 1295
https://jobs.foodtechconnect.com/companies/mastering-peptide-stacking-a-comprehensive-handbook/ https://jobs.foodtechconnect.com/companies/mastering-peptide-stacking-a-comprehensive-handbook
https://worldaid.eu.org/discussion/profile.php?id=1123478 can you take cjc 1295 ipamorelin and sermorelin together
https://careers.cblsolutions.com/employer/ipamorelin-applications-advantages-how-it-works-recommended-doses-and-potential-adverse-effects/ careers.cblsolutions.com
https://hirenhigher.co.nz/companies/mastering-peptide-stacking-a-comprehensive-handbook/ valley.md
https://nordwit.com/leonaoberle528 sermorelin vs ipamorelin which is better
https://www.fightdynasty.com/companies/synergistic-treatment-pairing-sermorelin-with-ipamorelin-for-enhanced-outcomes/ ipamorelin with sermorelin and cjc 1295
https://getshired.com/employer/ipamorelin-vs-sermorelin-key-distinctions-and-advantages/ getshired.com
https://recrutement.fanavenue.com/companies/testosterone-replacement-therapy-at-synergenx/ what is better sermorelin or ipamorelin
https://fijicareerhub.com/employer/ipamorelin-vs-sermorelin-bodybuilder-focused-benefits-dosage-and-blend-options/ https://fijicareerhub.com/employer/ipamorelin-vs-sermorelin-bodybuilder-focused-benefits-dosage-and-blend-options
https://emploi-securite.com/societes/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-therapy/ sermorelin and
ipamorelin: anti-aging peptides
https://artisfinishing.com/erika60v634832 sermorelin ipamorelin best
https://smartbusinesscards.in/refugiabeike35 what's better ipamorelin or sermorelin
https://urlshorter.xyz/maipicton8 https://urlshorter.xyz
https://apollo2b.com/shellilasseter ipamorelin and sermorelin injection locations
https://gotech.peep.company/shauntedeen999 sermorelin-ipamorelin-cjc1295 pills
https://jobbridge4you.com/employer/sermorelin-ipamorelin-the-peptide-blend-men-are-talking-about/ can you take ipamorelin and sermorelin together
https://www.makemyjobs.in/companies/blend-of-sermorelin-ipamorelin-10-mg-for-purchase/?-ipamorelin-%E2%80%93-10%E2%80%AFmg-for-purchase%2F www.makemyjobs.in
https://emploi-securite.com/societes/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-peptide-for-your-needs/ buy sermorelin-ipamorelin
https://oke.zone/profile.php?id=1098663 sermorelin ipamorelin treatment delivery
https://www.jobzalerts.com/companies/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ sermorelin ipamorelin benefits
https://malucarestaurant.ca/ethan736388081 sermorelin / ipamorelin
https://geniusquesthub.com/employer/sermorelin-vs-ipamorelin-comparing-two-growth-hormone-releasing-peptides/ cjc 1295 and ipamorelin vs sermorelin
https://analyticsjobs.in/jobs/companies/synergistic-regimen-sermorelin-ipamorelin/ valley.md
https://vads.in/index.php?page=user&action=pub_profile&id=491540 buy sermorelin and ipamorelin
https://vagas.grupooportunityrh.com.br/employer/ipamorelin-vs-sermorelin-an-in-depth-comparison-and-practical-guide/ https://vagas.grupooportunityrh.com.br/employer/ipamorelin-vs-sermorelin-an-in-depth-comparison-and-practical-guide/
https://recrutement.fanavenue.com/companies/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explained/ valley.md
https://thelegallock.com/job/companies/which-growth-hormone-secretagogue-reigns-supreme-a-side-by-side-look-at-sermorelin-ipamorelin-and-tesamorelin/ sermorelin vs
ipamorelin which is better
https://www.mvacancy.com/companies/ipamorelin-vs-sermorelin-deciding-which-growth-hormone-peptide-wins/ sermorelin/ipamorelin blend side
effects
https://dev-members.writeappreviews.com/employer/growth-hormone-secretagogues-showdown-sermorelin-vs-ipamorelin-explained/ compare ipamorelin and sermorelin
https://analyticsjobs.in/jobs/companies/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ difference between sermorelin and ipamorelin
https://eliteyachtsclub.com/employer/ipamorelin-applications-advantages-pharmacodynamics-prescribed-doses-and-adverse-effects/ difference between ipamorelin and sermorelin
https://hub.theciu.vn/lelakell57496 valley.md
https://miniurlz.com/flynn84f483148 miniurlz.com
http://mylivecard.com/mauricioucb270 mylivecard.com
https://careers.tu-varna.bg/employer/ipamorelin-vs-sermorelin-which-peptide-is-right-for-your-wellness-goals/ sermorelin + ipamorelin program
https://emploi-securite.com/societes/sermorelin-transformation-real-before-and-after-photos-results-and-timeline-breakdown/ ipamorelin sermorelin cycle
https://emploi-securite.com/societes/sermorelin-and-ipamorelin-mix-10-mg-for-purchase/ ipamorelin sermorelin dosage
https://dandaelitetransportllc.com/employer/ipamorelin-dosing-guide-and-optimal-timing-for-bodybuilders/ dandaelitetransportllc.com
https://10xhire.io/employer/synergistic-treatment:-combining-sermorelin-and-ipamorelin/ peg-mg ipamorelin and sermorelin series dosage
https://timviec24h.com.vn/companies/ipamorelin-vs-sermorelin-a-detailed-side-by-side-review-and-practical-buying-guide/ cjc 1295 ipamorelin sermorelin stack
https://kaykarbar.com/companies/tesamorelin-vs-ipamorelin-cjc-1295-head-to-head-review/ sermorelin / ipamorelin / cjc1295 500/250/100mcg rdt
https://thelegallock.com/job/companies/growth-hormone-boosters-showdown-sermorelin-vs-ipamorelin/ ipamorelin/cjc vs sermorelin
https://allgovtjobz.pk/companies/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explained/ sermorelin ipamorelin anti
aging
https://careers.universalair.aero/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ sermorelin ipamorelin anti aging
https://behired.eu/employer/sermorelin-ipamorelin-the-peptide-blend-men-are-talking-about/ behired.eu
http://mylivecard.com/holleytjangama mylivecard.com
https://robbarnettmedia.com/employer/cj1295-optimal-dosage-for-peak-performance/ can you stack sermorelin with cjc 1295 ipamorelin
https://wp.nootheme.com/jobmonster/dummy2/companies/sermorelin-vs-ipamorelin-a-side-by-side-look-at-growth-hormone-secretagogues/ cjc 1295 and ipamorelin vs sermorelin
https://rentry.co/33922-ipamorelin-vs-cjc-1295-a-comparative-overview sermorelin vs ipamorelin comparison
https://excelraise.com/employer/ipamorelin-applications-advantages-how-it-works-recommended-doses-and-potential-adverse-effects/ https://excelraise.com/employer/ipamorelin-applications-advantages-how-it-works-recommended-doses-and-potential-adverse-effects/
https://shige.77ga.me/home.php?mod=space&uid=199938&do=profile&from=space shige.77ga.me
https://careers.cblsolutions.com/employer/ipamorelin-vs-sermorelin-deciding-the-superior-growth-hormone-peptide/ sermorelin ipamorelin blend
10mg dosage
https://short.martinapps.shop/marissahinds2 can you take sermorelin and ipamorelin together
https://url.weburj.com/halinaetf76722 valley.md
https://www.alertesjob.com/employer/the-core-of-the-web/ www.alertesjob.com
https://thelegallock.com/job/companies/ipamorelin-vs-sermorelin-a-detailed-comparison-and-practical-guide/ sermorelin /
ipamorelin
https://bcstaffing.co/employer/701858/combining-sermorelin-and-ipamorelin-a-look-at-the-research-on-mixing-peptides ipamorelin and sermorelin injection locations
https://excelraise.com/employer/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ valley.md
https://tiroljobs24.at/unternehmen/tesamorelin-vs-sermorelin-peptide-solutions-for-enhancing-hgh/ is sermorelin or ipamorelin better
https://url.jobx.me/josephinemoyni sermorelin acetate ipamorelin
https://linkful.me/ralfmcmahan88 what does sermorelin ipamorelin for men
https://www.startup-door.com/employer/sermorelin-ipamorelin-blended-dosing-guide/ www.startup-door.com
https://aidesadomicile.ca/employer/sermorelin-and-ipamorelin-a-powerful-dual-peptide-combination/ what's better ipamorelin or sermorelin
https://pinecorp.com/employer/ipamorelin-vs-sermorelin-5-key-points-to-consider/ ipamorelin/sermorelin injections
https://empleos.getcompany.co/employer/ipamorelin-vs-sermorelin-choosing-the-best-peptide-therapy/ empleos.getcompany.co
https://parkerstewart.ie/employer/ipamorelin-vs.-sermorelin:-deciding-the-superior-growth-hormone-peptide/ ipamorelin and sermorelin suppliers
https://wadhefa.site/companies/is-a-sermorelin-and-ipamorelin-stack-worthy-of-consideration?/ sermorelin & ipamorelin blend 10mg dosage
https://coopervigrj.com.br/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ cjc 1295 ipamorelin vs sermorelin reddit
https://hitechjobs.me/companies/us-made-comparison-sermorelin-vs-ipamorelin-vs-tesamorelin-benefits/ ipamorelin sermorelin cjc pt-141 tb-500
https://advokatsthlm.se/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-peptide-for-you/ buy sermorelin and ipamorelin
https://www.naukrikro.com/companies/sermorelin-success-stories-real-transformations-key-takeaways/ valley.md
https://careers.tu-varna.bg/employer/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ difference between ipamorelin and sermorelin
https://syurl.com/chana357978238 sermorelin-ipamorelin-cjc1295 stack
https://dev.yayprint.com/finlands-top-energy-firms-unite-to-build-an-industrial-hydrogen-hub-3/ sermorelin-ipamorelin-cjc 1295 dosage
https://stepaheadsupport.co.uk/companies/sermorelin-vs-ipamorelin-which-is-superior/ https://stepaheadsupport.co.uk/
http://users.atw.hu/oldfastmt2board/index.php?PHPSESSID=0d150b4b0bccdf8404716f52e1632c58&action=profile;u=22295 users.atw.hu
https://www.cbl.aero/employer/sermorelin-vs-ipamorelin-which-is-superior/ valley.md
https://bertlierecruitment.co.za/employer/sermorelin-ipamorelin-a-powerful-peptide-combo/ valley.md
https://icmimarlikdergisi.com/kariyer/companies/ipamorelin-applications-and-advantages-how-it-works-recommended-dosing-and-potential-side-effects/ valley.md
https://bernard-guericolas.eu/index.php?action=profile;u=66876 valley.md
https://pinecorp.com/employer/ipamorelin-vs-sermorelin-5-key-points-to-consider/ sermorelin/ipamorelin blend
https://farmfruitbasket.com/2025/10/20/sermorelin-ipamorelin-the-peptide-blend-men-are-talking-about/ valley.md
https://linko.kosari.net/rafaelmccorkle buy sermorelin & ipamorelin
https://fastlinks.com.tr/ethanj74889674 sermorelin and ipamorelin price
https://www.bridgewaystaffing.com/employer/ipamorelin-vs-sermorelin-unraveling-the-distinct-benefits-of-two-peptide-treatments/ sermorelin vs ipamorelin vs tesamorelin
https://excelraise.com/employer/top-peptide-stack-picks-for-2025-the-definitive-guide/ can ipamorelin and sermorelin be taken together
https://fastlinks.com.tr/ethanj74889674 cjc 1295 ipamorelin vs sermorelin reddit
https://www.jobzalerts.com/companies/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ is it
safe combine sermorelin with cdc/ipamorelin together
https://link.cashcard.id/christopherbel valley.md
https://watchnow.site/senaidamusquit take
sermorelin and ipamorelin together same syringe
https://www.recruit-vet.co.uk/employer/synergistic-peptide-pairing:-sermorelin-meets-ipamorelin-in-dual-therapy-regimens/ sermorelin ipamorelin blend 10mg
dosage
https://reeltalent.gr/employer/sermorelin-vs-ipamorelin-choosing-the-right-peptide-for-your-needs/ valley.md
https://advokatsthlm.se/exploring-the-benefits-of-the-sermorelin-ipamorelin-peptide-blend-for-men-insights-from-novus-peptide-therapy-experts/ sermorelin ipamorelin blend peptide for men
https://classifieds.ocala-news.com/author/abdulsprent https://classifieds.ocala-news.com/author/abdulsprent
https://www.complete-jobs.co.uk/employer/navigating-the-side-effects-of-cjc-1295-and-ipamorelin https://www.complete-jobs.co.uk/employer/navigating-the-side-effects-of-cjc-1295-and-ipamorelin
https://theterritorian.com.au/index.php?page=user&action=pub_profile&id=2543667 sermorelin vs cjc
ipamorelin
https://cvcentrum.eu/companies/ipamorelin-vs-sermorelin-a-complete-comparison-and-practical-guide/ valley.md
https://sportsprojobs.net/employer/112107/sermorelin-in-bodybuilding-a-comprehensive-guide-to-advantages-applications-and-dosing/ peg-mg ipamorelin and sermorelin series dosage
https://eujobss.com/employer/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ cjc
1295 ipamorelin tesamorelin and sermorelin
https://phnompenhclassifieds.com/osclass/index.php?page=user&action=pub_profile&id=49562 sermorelin ipamorelin results
https://helpin.ge/employer/sermorelin-vs-cjc-1295-vs-ipamorelin-a-comparative-guide-to-growth-hormone-peptides/ sermorelin cjc 1295 and ipamorelin
https://advokatsthlm.se/sermorelin-dosage-cheat-sheet-optimal-amounts-for-peak-effectiveness/ 6 mg sermorelin 6mg ipamorelin
https://www.ayurjobs.net/employer/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ can you
take ipamorelin and sermorelin
http://awg.bplaced.net/smf/index.php?action=profile;u=32942 http://awg.bplaced.net/
https://gotech.peep.company/bonniebadham7 gotech.peep.company
https://somalibidders.com/employer/sermorelin-unveiled-key-advantages-and-how-it-works-for-you/ ipamorelin cjc 1295 vs sermorelin
https://jandlfabricating.com/employer/ipamorelin-vs-sermorelin-unpacking-key-distinctions-in-peptide-treatments/ sermorelin-ipamorelin-cjc1295:
the power trio for muscle growth
https://thelegallock.com/job/companies/mixing-sermorelin-and-ipamorelin-is-it-safe/ tesamorelin vs sermorelin vs ipamorelin
https://jandlfabricating.com/employer/cjc-1295-ipamorelin-10%e2%80%afmg-blend-optimal-dosage-guide/ cjc 1295 ipamorelin vs sermorelin
https://feelhospitality.com/employer/ipamorelin-vs-sermorelin-a-detailed-comparison-and-practical-guide/ ipamorelin vs sermorelin fatloss
https://www.jobseeker.my/employer/peptide-therapy-showdown-sermorelin-vs-cjc-1295-ipamorelin-and-liv-6/ valley.md
https://www.atlantistechnical.com/employer/tesamorelin-ipamorelin-synergistic-power-for-peak-results/ sermorelin and ipamorelin price
https://reeltalent.gr/employer/sermorelin-vs-ipamorelin-choosing-the-right-peptide-for-your-needs/ sermorelin ipamorelin blend peptide
for sale
https://krishnacareers.com/employer/sermorelin-ipamorelin-the-peptide-blend-men-are-talking-about/ take sermorelin and
ipamorelin together same syringe
https://talvisconnect.nl/employer/mixing-sermorelin-and-ipamorelin-is-it-possible/ valley.md
https://www.fightdynasty.com/companies/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ ipamorelin acetate/sermorelin
https://timviec24h.com.vn/companies/top-peptide-combos-for-rapid-recovery-weight-loss-longevity-and-beyond/ taking ipamorelin and sermorelin
https://careers.cblsolutions.com/employer/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explained/ sermorelin ipamorelin blend 10mg dosage
https://www.vytega.com/employer/ipamorelin-understanding-its-function-mechanism-and-rising-popularity/ ipamorelin sermorelin cycle
https://link.con3ct.com.br/roman50f00 valley.md
https://linkhaste.com/loraahmed32246 sermorelin / ipamorelin / cjc1295 500/250/100mcg rdt
https://seny.news/benjaminmcfadd sermorelin/ipamorelin dosage
https://sportsprojobs.net/employer/112149/ipamorelin-vs-sermorelin-which-peptide-is-right-for-your-wellness-goals/ sermorelin vs ipamorelin comparison
https://sportsprojobs.net/employer/112119/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ sermorelin ipamorelin before and after
https://talentrendezvous.com/companies/ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-others-a-head-to-head-review-of-leading-peptides/ buy sermorelin & ipamorelin
https://hub.theciu.vn/lupitamackinto what does sermorelin and ipamorelin do
http://mastersrq.online/imslonny991210 is ipamorelin better than sermorelin
https://thelegallock.com/job/companies/ipamorelin-vs-sermorelin-unraveling-key-distinctions-in-peptide-treatments/ valley.md
https://feniciaett.com/employer/ipamorelin-vs-sermorelin-what-bodybuilders-need-to-know-about-benefits-doses-and-popular-blends/ https://feniciaett.com/employer/ipamorelin-vs-sermorelin-what-bodybuilders-need-to-know-about-benefits-doses-and-popular-blends/
https://icmimarlikdergisi.com/kariyer/companies/advantages-of-pairing-ipamorelin-with-cjc-1295/ tesamorelin vs ipamorelin vs sermorelin
https://shortli.site/magdalenawinkl valley.md
https://jobs.foodtechconnect.com/companies/purchase-sermorelin-ipamorelin-blend-10-mg-pack/ sermorelin ipamorelin tesamorelin
https://avicounsel.com/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ sermorelin + ipamorelin blend
for sale
https://oke.zone/profile.php?id=1054553 https://oke.zone/
https://dokdo.in/melissaellery5 cjc ipamorelin vs sermorelin
https://linktree.biz/tomasw9201 sermorelin ipamorelin benefits
https://m.swiftstartechnology.co.za/employer/sermorelin-vs-cjc-1295-a-side-by-side-look-at-growth-hormone-releasing-peptides/ https://m.swiftstartechnology.co.za/employer/sermorelin-vs-cjc-1295-a-side-by-side-look-at-growth-hormone-releasing-peptides
https://analyticsjobs.in/jobs/companies/ipamorelin-vs-sermorelin-which-growth-hormone-peptide-reigns-supreme/ sermorelin ipamorelin treatment
delivery
https://careers.cblsolutions.com/employer/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explained/ ipamorelin sermorelin ghrp 2
https://ajira-hr.com/employer/growth-hormone-boosters-showdown-sermorelin-vs-ipamorelin/ sermorelin/ipamorelin blend side
effects
https://thelegallock.com/job/companies/ipamorelin-or-sermorelin-choosing-the-best-peptide-therapy/ buy
sermorelin & ipamorelin
https://obairseurope.com/employer/cjc-1295-vs.-sermorelin:-choosing-the-optimal-peptide-for-growth-hormone-stimulation/ https://obairseurope.com/employer/cjc-1295-vs.-sermorelin:-choosing-the-optimal-peptide-for-growth-hormone-stimulation
https://urllink.me/zoilawan161921 ipamorelin peptide vs sermorelin
https://vagyonor.hu/employer/growth-hormone-peptides-for-lyme-disease-using-cjc-1295-and-ipamorelin-to-promote-recovery/ is sermorelin or ipamorelin better
https://www.lookingforfresher.com/profile/adolphsmalley7 ipamorelin and sermorelin together
https://pakkjob.pk/companies/sermorelin-vs-cjc-1295-vs-ipamorelin-a-comparative-overview/ sermorelin peptide vs ipamorelin
https://anychinajob.com/companies/ipamorelin-vs-sermorelin-unpacking-key-distinctions-in-peptide-treatments/ sermorelin ipamorelin injection
https://dev-members.writeappreviews.com/employer/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ sermorelin ipamorelin and cjc 1295 stack
https://urlb.link/alonzowoolery1 what is better ipamorelin or sermorelin
https://nationalcarerecruitment.com.au/employer/sermorelin-vs-tesamorelin-choosing-the-right-hgh-peptide-for-your-needs/ valley.md
http://www.jobteck.co.in/companies/comparing-gh-peptides-tesamorelin-vs-sermorelin-ipamorelin-and-cjc-1295/ can you take cjc 1295
ipamorelin and sermorelin together
https://jobszimbabwe.co.zw/companies/sermorelin-dosage-guide-101-target-users-mechanism-and-outcomes-for-health-enthusiasts/ valley.md
https://adremcareers.com/employer/sermorelin-vs-cjc-1295-ipamorelin-choosing-the-right-growth-hormone-peptide-for-you/ sermorelin ipamorelin blend
peptide for men
https://profylelink.com/florianbellew sermorelin w ipamorelin
https://www.naukrikro.com/companies/sermorelin-success-stories-real-transformations-key-takeaways/ www.naukrikro.com
https://www.dynamicviewpoint.co.uk/employer/sermorelin-and-ipamorelin-a-potent-peptide-stack/ what is better ipamorelin or sermorelin
https://jobzz24.com/employer/ipamorelin-vs-sermorelin-deciding-the-superior-growth-hormone-peptide/ valley.md
https://felipesbackyard.com/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ valley.md
https://jobs.kwintech.co.ke/companies/ipamorelin-cjc-1295-a-powerful-synergy-for-peak-performance/ valley.md
https://careers.universalair.aero/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ sermorelin and ipamorelin: anti-aging peptides
https://careers.tu-varna.bg/employer/ipamorelin-dosing-guide-and-optimal-timing-for-bodybuilders/ careers.tu-varna.bg
https://wp.nootheme.com/jobmonster/dummy2/companies/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explained/ what
is sermorelin ipamorelin blend for men
https://dev-members.writeappreviews.com/employer/sermorelin-and-ipamorelin-a-powerful-dual-peptide-regimen/ sermorelin/ipamorelin results
https://maids-station.com/employer/ipamorelin-dose-planner-and-timing-guide-for-bodybuilders/ ipamorelin and sermorelin injection time
https://www.vytega.com/employer/ipamorelin-understanding-its-function-mechanism-and-rising-popularity/ sermorelin + ipamorelin program
https://fs-biolink.com/hellenclymer6 cjc ipamorelin vs sermorelin
https://candidates.giftabled.org/employer/maximizing-impact-the-synergy-of-tesamorelin-and-ipamorelin-for-enhanced-potency/ ipamorelin sermorelin ghrp 2
https://sun-clinic.co.il/he/question/ipamorelin-vs-sermorelin-a-complete-side-by-side-review-and-users-handbook/ valley.md
https://cloudcrunch.com/employer/ipamorelin-in-2025-advantages-recommended-doses-and-potential-hazards/ sermorelin ipamorelin and cjc 1295
stack
https://careers.tu-varna.bg/employer/ipamorelin-cjc-1295-how-this-peptide-duo-fuels-growth-and-recovery/ sermorelin ipamorelin blend dose
https://icmimarlikdergisi.com/kariyer/companies/sermorelin-vs-cjc-1295-vs-ipamorelin-a-comparative-review/ what's better ipamorelin or sermorelin
https://jandlfabricating.com/employer/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ aai
rejuvenation clinic testosterone sermorelin hgh ipamorelin
https://talentrendezvous.com/companies/ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-others-a-head-to-head-review-of-leading-peptides/ sermorelin ipamorelin blend reviews
https://jobs.foodtechconnect.com/companies/sermorelin-vs-ipamorelin-which-is-superior/ sermorelin ipamorelin 10mg blend dosage
https://firstmaid.sg/companies/ipamorelin-vs-sermorelin-key-differences-you-should-know/ sermorelin ipamorelin for sale
https://url.weburj.com/felishabartels ipamorelin sermorelin side effects
https://recrutement.fanavenue.com/companies/ipamorelin-vs-sermorelin-choosing-the-best-peptide-for-your-needs/ valley.md
https://ggapps.xyz/millamcilwrait can you take ipamorelin and sermorelin together
https://ssalty.com/janlongstaff86 ipamorelin acetate/sermorelin
https://onlinejob.lk/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ cjc 1295 ipamorelin sermorelin stack
https://classifieds.ocala-news.com/author/mqomari359 ipamorelin vs tesamorelin vs sermorelin
https://bcstaffing.co/employer/701921/ipamorelin-vs-sermorelin-unpacking-key-distinctions-in-peptide-treatments valley.md
https://candidates.giftabled.org/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-beyond/ sermorelin vs ipamorelin which is better
https://jobshop24.com/employer/tesamorelin-vs-cjc-1295-determining-the-superior-option/ take sermorelin and ipamorelin together same syringe
http://progress.matorres.com.br/index.php?action=profile;u=38564 ipamorelin acetate vs sermorelin
https://career.abuissa.com/employer/sermorelin-in-muscle-building-how-it-works-when-to-use-and-proper-dosing-guidelines/ career.abuissa.com
https://wp.nootheme.com/jobmonster/dummy2/companies/testosterone-replacement-therapy-at-synergenx/ oral efficacy of sermorelin ipamorelin cjc 1295
https://biolinks.stralite.com/ferdinanddonal difference between ipamorelin and sermorelin
https://ipo.fountain.agri.ruh.ac.lk/employer/sermorelin-and-ipamorelin-blend-optimal-dosage-guide/ valley.md
https://xqr.ai/deanbelste ipamorelin sermorelin blend
https://links.cleverlybox.com/jarrodadame14 sermorelin acetate ipamorelin
https://analyticsjobs.in/jobs/companies/ipamorelin-vs-sermorelin-key-differences-you-should-know/ sermorelin-ipamorelin-cjc 1295 dosage
https://www.dynamicviewpoint.co.uk/employer/sermorelin-and-ipamorelin-a-potent-peptide-stack/ ipamorelin and sermorelin injection
https://oke.zone/profile.php?id=1054515 cjc/sermorelin/ipamorelin
https://advokatsthlm.se/overview-of-the-sermorelin-and-ipamorelin-peptide-blend/ sermorelin / ipamorelin / cjc1295
500/250/100mcg rdt
https://bernard-guericolas.eu/index.php?action=profile;u=66884 sermorelin cjc 1295 and ipamorelin
https://rentry.co/93613-tesamorelin-vs-cjc-1295-determining-the-superior-choice-for-effectiveness sermorelin vs ipamorelin and tesamorelin
https://www.cbl.aero/employer/comparing-the-advantages-of-sermorelin-ipamorelin-and-tesamorelin-in-the-u-s/ sermorelin or ipamorelin
https://bio.slak.us/doretharus valley.md
https://advokatsthlm.se/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-peptide-for-you/ ipamorelin sermorelin bodybnuilding
https://thelegallock.com/job/companies/ipamorelin-applications-and-advantages-how-it-works-recommended-doses-and-potential-adverse-effects/ sermorelin vs ipamorelin reddit
https://www.ontheballpersonnel.com.au/2025/10/20/sermorelin-ipamorelin-combo-ideal-dosage-timing-and-results-for-peak-hgh-boost/ tesamorelin ipamorelin sermorelin
https://ftwjobfinder.com/companies/how-will-sermorelin-therapy-transform-your-health-expected-before-and-after-results/ sermorelin ipamorelin and cjc1295
https://iratechsolutions.com/employer/mixing-sermorelin-and-ipamorelin-is-it-possible/ valley.md
https://ipo.fountain.agri.ruh.ac.lk/employer/cjc-1295-vs-sermorelin-when-to-use-each-peptide-and-what-to-watch-out-for/ valley.md
https://cumbriasearch.co.uk/companies/sermorelin-ipamorelin-combo-complete-review-and-essential-insights/ sermorelin/ipamorelin blend side
effects
https://portalwe.net/employer/sermorelin-success-stories-transformative-outcomes-and-key-takeaways/ cjc 1295 ipamorelin vs sermorelin reddit
https://careers.cblsolutions.com/employer/ipamorelin-vs-sermorelin-choosing-the-superior-growth-hormone-peptide/ https://careers.cblsolutions.com
https://timviec24h.com.vn/companies/comparing-peptide-therapies-sermorelin-vs-cjc-1295-vs-ipamorelin/ sermorelin-ipamorelin-cjc1295:
https://careers.cblsolutions.com/employer/ipamorelin-vs-sermorelin-unpacking-the-distinct-peptide-treatment-approaches/ sermorelin ipamorelin blend
10mg dosage
https://careers.cblsolutions.com/employer/mixing-sermorelin-and-ipamorelin-is-it-safe/ ipamorelin and sermorelin injection time
https://rentry.co/83241-sermorelin--ipamorelin-combo-optimal-dosing-and-benefits-overview valley.md
https://academicsgate.com/employer/sermorelin-cjc-1295-and-ipamorelin-a-comparative-overview/ academicsgate.com
https://pagemelon.com/christiano https://pagemelon.com/christiano
https://litvids.org/dawnadecicco41 valley.md
https://body-positivity.org/groups/finlands-top-energy-firms-unite-to-build-an-industrial-hydrogen-hub/ body-positivity.org
https://skillproper.com/employer/ipamorelin-vs-sermorelin-a-detailed-side-by-side-review-and-practical-handbook/ valley.md
https://rentry.co/15575-sermorelin-advantages-proper-dosing-and-possible-side-effects sermorelin ipamorelin results
https://ttemployment.com/employer/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explored/ ipamorelin sermorelin ghrp 2
https://url.in.ps/lethaflagg5972 url.in.ps
https://slicethis.link/lawrencemontan sermorelin ipamorelin and cjc 1295 stack
https://emploi-securite.com/societes/ipamorelin-vs-sermorelin-which-growth-hormone-peptide-is-superior/ valley.md
https://craftsmansearch.com/employer/managing-side-effects-of-cjc-1295-and-ipamorelin/ valley.md
https://dadjobs.es/employer/tesamorelin-vs-sermorelin-which-peptide-drives-fat-reduction-and-muscle-recovery/ sermorelin/ipamorelin blend reviews
https://nationalcarerecruitment.com.au/employer/sermorelin-vs-tesamorelin-choosing-the-right-hgh-peptide-for-your-needs/ sermorelin/ipamorelin/theanine
https://helpin.ge/employer/sermorelin-vs-cjc-1295-vs-ipamorelin-a-comparative-guide-to-growth-hormone-peptides/ sermorelin ipamorelin tesamorelin
http://www.p2sky.com/home.php?mod=space&uid=6411361&do=profile www.p2sky.com
https://rentry.co/28360-comparing-the-advantages-of-sermorelin-ipamorelin-and-tesamorelin-in-the-us rentry.co
https://pascol.bio/vincentpreraue valley.md
https://shortli.site/arronhiggin187 sermorelin ipamorelin peptide
https://timviec24h.com.vn/companies/sermorelin-vs-cjc-1295-a-side-by-side-look-at-growth-hormone-releasing-peptides/ sermorelin ipamorelin reddit
https://coopervigrj.com.br/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ coopervigrj.com.br
https://candidates.giftabled.org/employer/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explored/ candidates.giftabled.org
https://reeltalent.gr/employer/sermorelin-vs-ipamorelin-choosing-the-right-peptide-for-your-needs/ is it safe combine
sermorelin with cdc/ipamorelin together
https://eujobss.com/employer/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ https://eujobss.com
https://www.1234.click/index.php?action=profile;u=48077 valley.md
https://careers.simplytech.co.za/employer/growth-hormone-peptide-showdown-sermorelin-vs-ipamorelin-explained/ sermorelin ipamorelin blend dosage
https://www.jobseeker.my/employer/peptide-therapy-showdown-sermorelin-vs-cjc-1295-ipamorelin-and-liv-6/ valley.md
http://mylivecard.com/mauricioucb270 ipamorelin vs sermorelin bodybuilding
http://users.atw.hu/oldfastmt2board/index.php?PHPSESSID=9f40b65ee2740776dd6fc6432c432226&action=profile;u=22294 take sermorelin and
ipamorelin together same syringe
https://sigorta.jobs/employer/mixing-sermorelin-and-ipamorelin-a-review-of-combined-use-in-research/ sermorelin ipamorelin blend
peptide for men
https://recruitmentfromnepal.com/companies/ipamorelin-unveiled-applications-advantages-how-it-works-recommended-doses-and-potential-risks/ sermorelin + ipamorelin blend
https://analyticsjobs.in/jobs/companies/tesamorelin-vs-sermorelin-choosing-the-best-growth-hormone-peptide-for-you/ https://analyticsjobs.in
https://www.cbl.aero/employer/combining-sermorelin-with-ipamorelin-is-it-safe-and-effective/ sermorelin ipamorelin blend dose
https://portalwe.net/employer/ipamorelin-vs-sermorelin-what-bodybuilders-need-to-know-about-benefits-doses-and-popular-blends/ https://portalwe.net/
https://www.cbl.aero/employer/synergistic-duo-sermorelin-ipamorelin-therapy/ aai rejuvenation clinic testosterone sermorelin hgh ipamorelin
https://infinitystaffingsolutions.com/employer/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-peptide-for-you/ which is stronger ipamorelin or sermorelin
https://tayseerconsultants.com/employer/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ sermorelin-ipamorelin-cjc1295 buy
https://onlinejob.lk/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ sermorelin vs ipamorelin and
tesamorelin
https://www.1234.click/index.php?action=profile;u=48074 sermorelin ipamorelin blend peptide for sale
https://excelraise.com/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ valley.md
https://sigorta.jobs/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ sermorelin + ipamorelin
https://thelegallock.com/job/companies/sermorelin-the-next-generation-ipamorelin-cjc-1295/ can you stack sermorelin with cjc 1295 ipamorelin
https://dev-members.writeappreviews.com/employer/sermorelin-and-ipamorelin-a-powerful-dual-peptide-regimen/ dev-members.writeappreviews.com
https://www.taptag.vc/erinvest124853 sermorelin ipamorelin blend
http://users.atw.hu/oldfastmt2board/index.php?PHPSESSID=a2438d8bb0ecf2c7d96a201b8a3eb219&action=profile;u=22291 valley.md
https://avicounsel.com/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ tesamorelin vs
sermorelin vs ipamorelin reddit
https://bernard-guericolas.eu/index.php?action=profile;u=66871 ipamorelin + sermorelin
https://www.9ks.info/index.php?action=profile;u=44819 valley.md
https://www.cbl.aero/employer/ipamorelin-vs-sermorelin-the-key-differences-you-should-know/ valley.md
https://bernard-guericolas.eu/index.php?action=profile;u=66881 https://bernard-guericolas.eu/
https://www.mmthealthcareltd.co.uk/employer/ipamorelin-vs-sermorelin-comparing-peptide-advantages/ ipamorelin sermorelin dosage
https://ddsbyowner.com/employer/ipamorelin-dosing-guide-and-optimal-timing-for-bodybuilders/ ddsbyowner.com
https://linkful.me/raleighfrancoi valley.md
https://jandlfabricating.com/employer/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ sermorelin ipamorelin cjc1295
https://infinitystaffingsolutions.com/employer/sermorelin-dosing-applications-and-comparative-review/ https://infinitystaffingsolutions.com/employer/sermorelin-dosing-applications-and-comparative-review/
https://oke.zone/profile.php?id=1098674 valley.md
https://iratechsolutions.com/employer/top-peptide-stack-picks-for-2025-the-definitive-guide/ tesamorelin vs sermorelin vs ipamorelin reddit
https://remotejobs.website/profile/quentinpalombo remotejobs.website
https://jobs.foodtechconnect.com/companies/sermorelin-success-stories-real-transformations-key-takeaways/ what does
sermorelin and ipamorelin do
https://dev-members.writeappreviews.com/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ sermorelin-ipamorelin-cjc1295: the power trio for muscle growth
https://ajira.co.tz/profile/juanchumley634 valley.md
https://kasyfy.com/employer/synergistic-growth-therapy-combining-sermorelin-and-ipamorelin sermorelin-ipamorelin-cjc 1295
https://jobs.foodtechconnect.com/companies/purchase-sermorelin-ipamorelin-blend-10-mg-pack/ can you take ipamorelin and sermorelin together
https://portalwe.net/employer/which-growth-hormone-peptide-wins-ipamorelin-or-sermorelin/ ipamorelin vs
tesamorelin vs sermorelin
https://careers.tu-varna.bg/employer/sermorelin-vs-ipamorelin-a-head-to-head-review-of-anti-aging-peptides/ https://careers.tu-varna.bg/employer/sermorelin-vs-ipamorelin-a-head-to-head-review-of-anti-aging-peptides
https://advokatsthlm.se/sermorelin-ipamorelin-the-power-pairing-of-a-winning-peptide-stack/ valley.md
https://theterritorian.com.au/index.php?page=user&action=pub_profile&id=2543667 valley.md
https://qr.miejtech.com/winonamize1618 buy sermorelin &
ipamorelin blend
https://excelraise.com/employer/ipamorelin-vs-cjc-1295-which-growth-hormone-secretagogue-wins/ sermorelin/ipamorelin before and after
https://sewajob.com/employer/ipamorelin-vs-sermorelin-a-side-by-side-comparison-of-growth-hormone-secretagogues/ buy sermorelin and ipamorelin
https://careers.cblsolutions.com/employer/filter-enclosures/ valley.md
https://candidates.giftabled.org/employer/maximizing-impact-the-synergy-of-tesamorelin-and-ipamorelin-for-enhanced-potency/ sermorelin and
ipamorelin dosage
https://thelegallock.com/job/companies/sermorelin-vs-ipamorelin-which-is-superior/ sermorelin-ipamorelin-cjc1295 stack
http://forum.emrpg.com/home.php?mod=space&uid=1413863&do=profile ipamorelin/sermorelin dosage
https://10xhire.io/employer/real-world-evidence-of-multiple-myeloma-treatment-(2013-2019)-in-the-hospital-district-of-helsinki-and-uusimaa,-finland/ https://10xhire.io/employer/real-world-evidence-of-multiple-myeloma-treatment-(2013-2019)-in-the-hospital-district-of-helsinki-and-uusimaa,-finland
https://portalwe.net/employer/mixing-sermorelin-and-ipamorelin-is-it-possible/ portalwe.net
https://jandlfabricating.com/employer/sermorelin-ipamorelin-blend-optimal-dosage-guide/ valley.md
https://10xhire.io/employer/sermorelin-+-ipamorelin:-the-peptide-blend-men-are-talking-about/ ipamorelin sermorelin bodybnuilding
https://adremcareers.com/employer/synergistic-peptide-regimen-sermorelin-plus-ipamorelin/ sermorelin ipamorelin blend dose
https://ipo.fountain.agri.ruh.ac.lk/employer/tesamorelin-vs-ipamorelin-distinct-advantages-clinical-applications-and-core-variations/ valley.md
https://thelegallock.com/job/companies/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ https://thelegallock.com/job/companies/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide
https://classifieds.ocala-news.com/author/orlando70n0 sermorelin & ipamorelin
https://bcstaffing.co/employer/701535/us-made-peptides-showcasing-their-advantages-sermorelin-vs-ipamorelin-vs-tesamorelin sermorelin & ipamorelin blend 10mg dosage
https://body-positivity.org/groups/maximizing-results-the-power-combo-of-tesamorelin-and-ipamorelin/ sermorelin ipamorelin blend
dose
https://anychinajob.com/companies/mixing-sermorelin-and-ipamorelin-is-it-safe/ valley.md
https://www.jobexpertsindia.com/companies/top-peptide-stack-picks-for-2025-the-definitive-guide/ valley.md
https://jandlfabricating.com/employer/synergistic-treatment-combining-sermorelin-and-ipamorelin/ valley.md
https://emploi-securite.com/societes/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-therapy/ emploi-securite.com
https://okay.com.gr/employer/sermorelin-peptides-exploring-the-risks-and-benefits-for-men/ sermorelin ipamorelin treatment delivery
https://url.weburj.com/felishabartels valley.md
https://coopervigrj.com.br/employer/sermorelin-vs-ipamorelin-a-head-to-head-look-at-anti-aging-peptide-treatments/ ipamorelin sermorelin blend
dosage
https://dbitly.com/keriprendivill https://dbitly.com
https://mupf.me/burtonbottrill sermorelin ipamorelin blend peptide for sale
https://links.trafficninja.net/gilbertrow ipamorelin vs sermorelin vs tesamorelin
https://careerfy.pl/employer/tesamorelin-vs-sermorelin-which-peptide-best-enhances-hgh/ sermorelin ipamorelin blend
side effects
http://forum.emrpg.com/home.php?mod=space&uid=1413877&do=profile http://forum.emrpg.com/home.php?mod=space&uid=1413877&do=profile
https://infinitystaffingsolutions.com/employer/tesamorelin-vs-sermorelin-peptide-solutions-for-enhancing-hgh/ infinitystaffingsolutions.com
https://forwardingjobs.com/companies/sermorelin-vs-ipamorelin-which-peptide-is-better-for-anti-aging/ valley.md
https://academiabelezza.com/employer/growth-hormone-boosters-showdown-sermorelin-vs-ipamorelin-explained/ academiabelezza.com
https://classifieds.ocala-news.com/author/orlando70n0 valley.md
https://rentry.co/18773-determining-the-right-dose-for-ipamorelin https://rentry.co/18773-determining-the-right-dose-for-ipamorelin
https://jobs.foodtechconnect.com/companies/sermorelin-success-stories-transformative-outcomes-and-key-takeaways/ cjc 1295 and ipamorelin vs sermorelin
https://digitalsnax.com/geritimmons920 sermorelin ipamorelin 10mg blend dosage
https://trabajaensanjuan.com/employer/combining-sermorelin-and-ipamorelin-a-look-at-the-research-on-mixing-peptides/ sermorelin and ipamorelin stack
https://investsolutions.org.uk/employer/cjc-1295-vs-sermorelin-how-they-compare-in-use-benefits-and-practical-considerations/ sermorelin-ipamorelin-cjc 1295
https://pinecorp.com/employer/sermorelin-vs-cjc-1295-how-to-pick-the-right-peptide-therapy-for-you/ pinecorp.com
https://excelraise.com/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ sermorelin-ipamorelin-cjc1295
https://jobsforfiji.com/companies/sermorelin-vs-ipamorelin-choosing-the-right-peptide-for-your-needs/ valley.md
https://www.referall.us/employer/tesamorelin-vs-ipamorelin-a-comprehensive-peptide-comparison-guide/ valley.md
https://alumni.tu-sofia.bg/employer/sermorelin-vs-ipamorelin-key-differences-explained/ sermorelin & ipamorelin blend
https://rentry.co/56080-ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment sermorelin / ipamorelin / cjc1295 500/250/100mcg rdt
https://ozzojobs.com/employer/235468/sermorelin-transformation-anticipating-results-from-growth-hormone-treatment sermorelin/ipamorelin blend benefits
https://careers.universalair.aero/employer/sermorel-the-next-generation-combo-of-ipamorelin-and-cjc-1295/ can ipamorelin and sermorelin be taken together
https://www.teacircle.co.in/ipamorelin-vs-sermorelin-comparing-the-peptide-advantages/ sermorelin vs ipamorelin and tesamorelin
https://volunteeri.com/companies/ipamorelin-vs-tesamorelin-key-differences-explained-by-dr-jenn-at-medclub/ https://volunteeri.com/companies/ipamorelin-vs-tesamorelin-key-differences-explained-by-dr-jenn-at-medclub/
https://grupokandidat.com/compa%C3%B1ias/us-made-peptides-showcasing-their-advantages-sermorelin-vs-ipamorelin-vs-tesamorelin/ ipamorelin and sermorelin stack
https://fskdigital.com/brennapullman2 sermorelin vs
ipamorelin reddit
https://saek-kerkiras.edu.gr/employer/hgh-boosting-peptides-showdown-tesamorelin-vs-sermorelin/ sermorelin cjc 1295 and ipamorelin
https://klm9.net/employer/sermorelin-vs-cjc-1295-ipamorelin-choosing-the-right-growth-hormone-peptide-for-you/ https://klm9.net
https://abatsport.com/real-world-evidence-of-multiple-myeloma-treatment-2013-2019-in-the-hospital-district-of-helsinki-and-uusimaa-finland/ aai rejuvenation clinic testosterone sermorelin hgh ipamorelin
http://poderdiario.com/ermamoniz93990 valley.md
https://thelegallock.com/job/companies/sermorelin-results-anticipated-changes-with-growth-hormone-treatment/ ipamorelin vs
sermorelin fatloss
https://hemoncjobs.com/employer/tesamorelin-vs-sermorelin-peptide-solutions-for-enhancing-hgh/ tesamorelin ipamorelin sermorelin
https://surl.xyz/madgeclemens4 valley.md
https://linksminify.com/rolandzif90285 sermorelin & ipamorelin blend 10mg
dosage
https://alms.education/blog/index.php?entryid=139374 sermorelin ipamorelin anti aging delivery
https://prel.ink/meghan12832162 cjc 1295 ipamorelin tesamorelin and
sermorelin
https://alumni.tu-sofia.bg/employer/cjc-1295-vs-sermorelin-uses-applications-and-key-considerations/ alumni.tu-sofia.bg
https://ijb.org.in/employer/is-mixing-sermorelin-and-ipamorelin-safe/ ijb.org.in
https://waslah.agency/employer/mastering-ipamorelin-cycles-ideal-doses-scheduling-and-top-peptide-combinations/ sermorelin ipamorelin anti
aging delivery
https://feelhospitality.com/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ sermorelin vs ipamorelin for muscle growth
https://www.startup-door.com/employer/sermorelin-ipamorelin-blended-dosing-guide/ sermorelin ipamorelin and cjc 1295 stack
https://www.sitiosecuador.com/author/robweed739/ what does
sermorelin and ipamorelin do
https://www.paknaukri.pk/companies/top-peptide-stack-picks-of-2025-your-comprehensive-guide/ valley.md
https://emploi-securite.com/societes/ipamorelin-vs-sermorelin-which-growth-hormone-peptide-is-superior/ valley.md
https://wp.nootheme.com/jobmonster/dummy2/companies/ipamorelin-cjc-1295-a-powerful-synergy-for-peak-performance/ ipamorelin with sermorelin and
cjc 1295
https://globejobsaid.com/employer/ipamorelin-vs-sermorelin-choosing-the-right-growth-hormone-peptide/ valley.md
https://jobs-classifieds.com/employer/how-will-sermorelin-therapy-transform-your-health-expected-before-and-after-results/ sermorelin ipamorelin 10mg blend dosage
https://getshired.com/employer/ipamorelin-vs-sermorelin-key-distinctions-and-advantages/ ipamorelin with sermorelin and cjc 1295
https://academiabelezza.com/employer/growth-hormone-boosters-showdown-sermorelin-vs-ipamorelin-explained/ valley.md
http://www.dungdong.com/home.php?mod=space&uid=3241626&do=profile can ipamorelin and sermorelin be taken together
https://ninula.com/employer/ipamorelin-vs-sermorelin-choosing-the-ideal-peptide-treatment/ sermorelin vs ipamorelin for weight loss
http://www.jobteck.co.in/companies/mastering-peptide-stacking-a-comprehensive-handbook/ sermorelin-ipamorelin-cjc1295 pills
https://ghibta.org/employer/sermorelin-vs-ipamorelin-a-side-by-side-review-of-growth-hormone-peptides/ sermorelin vs cjc 1295 ipamorelin
https://directlineglobal.com/companies/sermorelin-success-stories-transformations-and-key-takeaways/ valley.md
https://spin.org.pk/employer/peptide-showdown-ipamorelin-vs-tesamorelin-sermorelin-cjc-1295-and-the-rest-of-the-field/ sermorelin/ipamorelin before and after
https://lamachineataffer.com/entreprises/ipamorelin-vs-sermorelin-which-one-suits-your-needs-best/ ipamorelin sermorelin blend
https://pinecorp.com/employer/sermorelin-vs-cjc-1295-how-to-pick-the-right-peptide-therapy-for-you/ sermorelin & ipamorelin blend 10mg dosage
https://candidates.giftabled.org/employer/maximizing-impact-the-synergy-of-tesamorelin-and-ipamorelin-for-enhanced-potency/ sermorelin/ipamorelin blend benefits
https://jobs.atlanticconcierge-gy.com/employer/cjc-1295-vs-ipamorelin-which-one-wins/ ipamorelin/sermorelin
http://www.oakee.cn:3000/kermitfrodsham http://www.oakee.cn:3000/kermitfrodsham
https://gitea.zerova.com/quintongoodcha https://gitea.zerova.com/quintongoodcha
http://gitea.yunshanghub.com:8081/lacey87d483359 gitea.yunshanghub.com
http://libochen.cn:13000/augustaboddie1 libochen.cn
http://git.chelingzhu.com/louveniawienho/louvenia2021/wiki/Insulin-%25C3%25A4hnlicher+Wachstumsfaktor+I+%2528IGF-I%2529 git.chelingzhu.com
https://deaddeaddead.store/ariellehollenb deaddeaddead.store
https://thefusionflix.com/@dustycase47272?page=about thefusionflix.com
https://gitea.tpss.top/charlieclick29 gitea.tpss.top
http://git.miaokids.com/baileywatterst git.miaokids.com
https://git.outsidecontext.solutions/jamiecaballero git.outsidecontext.solutions
https://cacklehub.com/@modestoreinoso?page=about cacklehub.com
https://nonoclick.com/read-blog/46918_pfizer-und-die-einsatzmoglichkeiten-von-wachstumshormontherapien.html nonoclick.com
http://ggzypz.org.cn:8664/rogeliotromble http://ggzypz.org.cn/
https://great-worker.com/scottygottscha https://great-worker.com
https://maintain.basejy.com/jennybouchard3 maintain.basejy.com
https://gitea.alaindee.net/lynmacleod0294 gitea.alaindee.net
https://music.1mm.hk/kpmrandy04963 music.1mm.hk
http://guanli.jiance.cn:3000/faustospivakov guanli.jiance.cn
https://git.jbangit.com/carolyn2095523 git.jbangit.com
https://nucleation.fusion.bref.cool/tamfarris88541/academicsgate.com6742/wiki/Somatropin+%25E2%2580%2593+Online+kaufen%253A+Preis%252C+Verf%25C3%25BCgbarkeit+und+rechtliche+Aspekte nucleation.fusion.bref.cool
http://tafiyata.saving.com.ng/read-blog/27339_wachstumshormonmangel.html http://tafiyata.saving.com.ng
https://amcompany.ir/read-blog/362_rechnungslegungsstandards-nach-hgb-und-ifrs-einfach-erklart-herrmann-may-treuhan.html amcompany.ir
https://git.deadpoo.net/partheniat0245 git.deadpoo.net
https://www.humlog.social/read-blog/4810_hgh-was-ist-ein-wachstumshormon.html https://www.humlog.social/read-blog/4810_hgh-was-ist-ein-wachstumshormon.html
http://www.mindepoch.com:9092/roseannegrano7 http://www.mindepoch.com:9092/roseannegrano7
http://git.vicagroup.com.cn/frwkristan213 git.vicagroup.com.cn
http://code.sikey.com.cn/josie071052968 code.sikey.com.cn
https://git.mklpiening.de/eugenionewland git.mklpiening.de
https://git.ajattix.org/brooksaiston2 https://git.ajattix.org/brooksaiston2
https://git.connectplus.jp/darylranking5 git.connectplus.jp
https://gitea.jobiglo.com/mamiefranks190 https://gitea.jobiglo.com/mamiefranks190
https://easydating.shop/@deniceraposo3 easydating.shop
https://git.hanckh.top/derekasr917480 git.hanckh.top
https://nrimatchmaking.com/@vadagholson45 https://nrimatchmaking.com/@vadagholson45
https://git.ellinger.eu/palmacollier92/7118180/wiki/Staatsunabh%C3%A4ngige-Theologische-Hochschule-Basel git.ellinger.eu
https://fyahtrak.com/maryloucarter fyahtrak.com
https://gitea.offends.cn/brigidacrawfor gitea.offends.cn
https://git.ultra.pub/meganhoag13696 git.ultra.pub
https://tintinger.org/emmanuelnevile tintinger.org
http://tigerpi.cn:3000/ulyssesmunger5 http://tigerpi.cn:3000/ulyssesmunger5
https://beatsong.app/norinejameson beatsong.app
https://tehranafro.com/abbygirard3971 tehranafro.com
https://git.kraft-werk.si/wztjanis998619 git.kraft-werk.si
http://dibodating.com/@fideliatfz3241 http://dibodating.com/@fideliatfz3241
https://git.gonstack.com/evabattle32185 git.gonstack.com
https://git.camus.cat/lincolnferguso https://git.camus.cat/lincolnferguso
https://music.michaelmknight.com/holly88u103643 music.michaelmknight.com
https://gitiplay.com/@steffenspady89?page=about https://gitiplay.com/
https://www.appleradish.org/leannemadgwick/mbableu.com1997/wiki/HGH-Produkte-mit-Aminos%C3%A4uren-%E2%80%93-Jetzt-bei-Pharmasports-bestellen www.appleradish.org
http://nas.zeroj.net:3000/renemosman369 nas.zeroj.net
https://myclassictv.com/@paulettebumgar?page=about https://myclassictv.com/
https://git.izen.live/kimberley55x06/kimberley2021/wiki/Auswirkung+der+Wachstumshormontherapie+auf+die+endg%25C3%25BCltige+K%25C3%25B6rpergr%25C3%25B6%25C3%259Fe+von+Kindern+mit+idiopathischer+Kurzv%25C3%25BCdrigkeit%253A+Systematische+%25C3%259Cbersicht git.izen.live
https://easyconnect.fun/@sonjolley59521 easyconnect.fun
https://energypowerworld.co.uk/read-blog/247655_igf-1-und-der-insulin-signalweg-schlusselkomponenten-der-metabolischen-kontrolle.html https://energypowerworld.co.uk
https://nexnex.site/read-blog/65_wachstumshormone-als-medikament.html nexnex.site
https://socialx.samtech-x.com/read-blog/39_hgh-wirkung-risiken-und-einsatz-von-somatropin.html https://socialx.samtech-x.com/
http://repo.bpo.technology/marianoroden3 repo.bpo.technology
https://git.nusaerp.com/kandismetters git.nusaerp.com
https://git.pingupod.de/brucedecicco21 git.pingupod.de
https://ashishsaini.site/read-blog/4291_wachstumshormon-und-alterung-eine-klinische-ubersicht.html ashishsaini.site
https://tube.denthubs.com/@rosemariereitz?page=about tube.denthubs.com
http://git.scxingm.cn/izettalowerson http://git.scxingm.cn/izettalowerson
https://theindievibes.com/anibalgonsalve https://theindievibes.com/anibalgonsalve
http://test-www.writebug.com:3000/toryvargas1974 http://test-www.writebug.com/
http://libochen.cn:13000/augustaboddie1 http://libochen.cn
https://gitea.abra.me/danniecroteau3 gitea.abra.me
https://sistemagent.com:8081/rashadkiley50 sistemagent.com
https://git.jerl.dev/florpollock903 git.jerl.dev
https://www.chenisgod.com:3096/kristalfenston https://www.chenisgod.com:3096/kristalfenston
https://www.ituac.com/caitlinhaggert https://www.ituac.com/caitlinhaggert
http://provision-sa.co.za:3000/billf05882419 http://provision-sa.co.za:3000/billf05882419
http://www.w003.cloud:8418/roscoefreeland www.w003.cloud
Химчистка ковров с выравниванием ворса! Ковер выглядит объемным!
<a href=https://remont-uborka.ru/>сухая уборка</a>
Клининговая компания проявила гибкость в графике уборки!
<a href=https://uborka-26.ru/>генеральная уборка квартиры</a>
Быстрая доставка с утра!Все свежее и ароматное!
<a href=https://svstrazh.forum24.ru/?1-3-0-00000403-000-0-0-1756469890>розы купить в томске</a>
Ни разу не пожалела, что выбрала именно вашу компанию. От оформления заказа до вручения – всё прошло на высшем уровне. Рекомендую вас всем знакомым.
<a href=https://superogorod.ucoz.org/forum/2-4256-1>купить букет роз томск</a>
https://git.xzjz.cc/ashlidonoghue git.xzjz.cc
https://christianmail.tv/@alejandrofeast?page=about christianmail.tv
https://jovita.com/robbietench597 jovita.com
https://theudtaullu.com/@hungmondragon1?page=about https://theudtaullu.com
https://git.ezmuze.co.uk/margarita90209 git.ezmuze.co.uk
https://code.openmobius.com:3001/bonniebohannon/krishnacareers.com2010/wiki/HGH-f%C3%BCr-Frauen-%E2%80%93-Zyklus%3A-Vorteile-und-Nebenwirkungen code.openmobius.com
https://lius.familyds.org:3000/lilabruner6138 https://lius.familyds.org
https://git.lokalix.de/dxilina9981374 git.lokalix.de
https://vidyadarshiniias.in/read-blog/9_somatropin.html vidyadarshiniias.in
https://koseongnam.com/sandra56439226 https://koseongnam.com/sandra56439226
https://www.chembans.com/@salinakeynes49 https://www.chembans.com
https://bantoomusic.com/orlandoancher2 bantoomusic.com
https://rhapsodyofrealities.abilliontestimoniesandmore.org/@lorrifagan706?page=about rhapsodyofrealities.abilliontestimoniesandmore.org
http://gitea.ucarmesin.de/pedromitten010/6474811/wiki/Wachstumshormon%3A-Bildung-und-Funktion http://gitea.ucarmesin.de/pedromitten010/6474811/wiki/Wachstumshormon:-Bildung-und-Funktion
https://grafana.jasonstolle.com/benedicth36582 grafana.jasonstolle.com
https://git.svidoso.com/merryxkd805984 git.svidoso.com
https://isabelzarate.com/nathanalarcon8 isabelzarate.com
http://nas.killf.info:9966/alyciamcclendo nas.killf.info
Мытье полов выполнено тщательно! Плитка и паркет выглядят как новые!
<a href=https://uborka-26.ru/>уборка офисов</a>
Химчистка дивана с выведением пятен! Справились со старыми загрязнениями!
<a href=https://remont-uborka.ru/>мытье окон</a>
Идеальный букет для учителя!Благодарность в цветах!
<a href=https://pelsh.forum24.ru/?1-8-0-00000544-000-0-0-1756376575>доставка цветов</a>
https://vcs.int.feuerwehr-ziemetshausen.de/luellas9414638 https://vcs.int.feuerwehr-ziemetshausen.de/
https://mmctube.com/@leilani852926?page=about mmctube.com
https://git.hexaquo.at/lucretiawherry git.hexaquo.at
https://streamifyr.com/@cruzloyola4450?page=about https://streamifyr.com/
http://guishenking.cloud:3000/anniecockle813 guishenking.cloud
http://demo.sunflowermachinery.com/jerripoidevin2 demo.sunflowermachinery.com
https://git.erdei-dev.hu/aubreydun37149 git.erdei-dev.hu
https://bk-house.synology.me:3081/frankschnieder https://bk-house.synology.me:3081/frankschnieder
https://videyme.online/@joannakibby632?page=about videyme.online
https://myhealthypunjab.com/@luisbright9982?page=about myhealthypunjab.com
https://maintain.basejy.com/lindsayhowey07 maintain.basejy.com
https://simapodcast.co.ls/@evefranki57593?page=about https://simapodcast.co.ls
https://platform.giftedsoulsent.com/candace28x8240 https://platform.giftedsoulsent.com/candace28x8240
https://www.lizyum.com/@mitchellmorse lizyum.com
https://gitea.ashcloud.com/mervinwatkins1 https://gitea.ashcloud.com/mervinwatkins1
https://git.mklpiening.de/albertinareddy https://git.mklpiening.de/albertinareddy
https://www.telugustatusvideo.com/@lorie254569075?page=about https://www.telugustatusvideo.com/@lorie254569075?page=about
https://supardating.com/@vanessamays805 supardating.com
Как хорошо, что вы показываете букеты в разных ценовых категориях! Смогла подобрать роскошные розы на 8 Марта по доступной цене!
<a href=https://t.me/cvetaevatomskru/465>розы томск</a>
Невероятно красивые маки!Яркие и трепетные!
<a href=https://cah.forum24.ru/?1-13-0-00002580-000-0-0-1756376478>свадебный букет</a>
Ваши фото праздничных композиций вдохновили на заказ роз с эвкалиптом на Новый год - пахло свежестью и праздником!
<a href=https://t.me/cvetaevatomskru/30>заказать цветы томск</a>
http://provision-sa.co.za:3000/virgildavitt54 provision-sa.co.za
http://provision-sa.co.za:3000/madelinechurch/3694416/wiki/Insulin-%C3%A4hnlicher-Wachstumsfaktor-I-%28IGF-I%29 provision-sa.co.za
https://git.cnml.de/rozellabeckham https://git.cnml.de/rozellabeckham
https://ste-van.de/dian68t3469005 ste-van.de
https://aipod.app/brendanride235 aipod.app
https://git.51aspx.com/benedictwakefi https://git.51aspx.com/
https://git.saintdoggie.org/elanagriffis3 git.saintdoggie.org
https://movieru.jp/portfolio/@eliseralph6242?page=about movieru.jp
https://wiki.idealirc.org/indiragaertner wiki.idealirc.org
https://zm.aosenhw.com/@ferminc8653515 https://zm.aosenhw.com/
https://isabelzarate.com/nbqannetta137 isabelzarate.com
https://nrisoulmate.com/@thomasq330509 nrisoulmate.com
https://git.poly.zone/jay90217455214 git.poly.zone
https://mobishorts.com/@hollyrapke4199?page=about mobishorts.com
https://gitea.fcliu.net/catherineangul https://gitea.fcliu.net
https://git.51aspx.com/benedictwakefi https://git.51aspx.com/
https://thefusionflix.com/@lindsey77k0311?page=about https://thefusionflix.com
https://zoucast.com/tanjaappleton zoucast.com
https://git.arachno.de/hellenfitzpatr https://git.arachno.de
https://viraltubex.com/@randolphsmerd?page=about https://viraltubex.com/
https://git.ellinger.eu/dann72m078440 https://git.ellinger.eu
https://git.mklpiening.de/luzbowman10411/q8at.link1991/wiki/Pfizer git.mklpiening.de
https://git.karma-riuk.com/davisneill2886 git.karma-riuk.com
https://freevideocanal.com/@jeraldfairweat?page=about https://freevideocanal.com/
https://dev.dhf.icu/adriana43a5187 dev.dhf.icu
http://ysx.myds.me:3005/beatrizignacio http://ysx.myds.me
http://iskame.bg.cm/@beulah52029729 iskame.bg.cm
https://gitea.adminakademia.pl/harrisonbaudin https://gitea.adminakademia.pl/harrisonbaudin
https://cacklehub.com/@magdacuellar8?page=about https://cacklehub.com/@magdacuellar8?page=about
http://gitea.shundaonetwork.com/alicaalvarado4 gitea.shundaonetwork.com
https://www.aservicehost.ru/evanseabrook20 www.aservicehost.ru
https://git.hexdive.com/viola184622007 git.hexdive.com
https://music.growverse.net/shirley5557650 https://music.growverse.net/shirley5557650
https://worldclassdjs.com/danielciantar9 worldclassdjs.com
http://newslabx.csie.ntu.edu.tw:3000/joshwentcher3 http://newslabx.csie.ntu.edu.tw/
https://git.esc-plus.com/vernonantonief git.esc-plus.com
https://git.toad.city/chadreaves771 git.toad.city
https://playidy.com/@celeste12l6087?page=about https://playidy.com/@celeste12l6087?page=about
https://git.tbaer.de/ouidaarek21986 git.tbaer.de
https://jenkins.txuki.duckdns.org/twilahalligan jenkins.txuki.duckdns.org
https://intalnirisecrete.ro/@gavinmcfarland https://intalnirisecrete.ro
https://mardplay.com/melvacruicksha mardplay.com
https://megastream.pl/@cindy993773661?page=about https://megastream.pl/@cindy993773661?page=about
https://gitea.mpc-web.jp/urylamar236155 gitea.mpc-web.jp
https://www.arabianmatrimony.com/@kendallgerlach www.arabianmatrimony.com
https://music.growverse.net/galecountryman music.growverse.net
https://www.superphage.org/malissasmartt https://www.superphage.org/malissasmartt
https://playxtream.com/@corrineconway?page=about playxtream.com
https://music.growverse.net/shirley5557650 music.growverse.net
https://git.cnml.de/marccraft03936 git.cnml.de
https://bernard-guericolas.eu/index.php?action=profile;u=70531 bernard-guericolas.eu
https://lensez.info/louiespringtho https://lensez.info/louiespringtho
https://bluebirdmusic.in/@magda534583329?page=about bluebirdmusic.in
https://git.cnml.de/marccraft03936 https://git.cnml.de/marccraft03936
https://git.suika.org/leiaaddison87 git.suika.org
https://git.lokalix.de/susannabellino git.lokalix.de
https://gitea.ontoast.uk/meribracy3779 https://gitea.ontoast.uk/meribracy3779
https://git.lodis.se/margiekozlowsk https://git.lodis.se/
http://oa.sccehui.com:6101/piperbaskett53 oa.sccehui.com
https://g.6tm.es/omaoda84559982 g.6tm.es
https://repo.komhumana.org/halliebodenwie repo.komhumana.org
https://mobishorts.com/@philomenalawye?page=about https://mobishorts.com/
https://gitea.alaindee.net/fawnp889914238 gitea.alaindee.net
http://gitea.liaozhuangkeji.com/qrtmyron55385 gitea.liaozhuangkeji.com
https://git.17pkmj.com:3000/howardheffron git.17pkmj.com
https://grabtv.xyz/@esthercribbs85?page=about grabtv.xyz
https://git.dadunode.com/thurmanbarfiel https://git.dadunode.com/thurmanbarfiel
https://bernard-guericolas.eu/index.php?action=profile;u=70469 https://bernard-guericolas.eu/
https://gitea.fcliu.net/tonyspangler45 gitea.fcliu.net
http://xcfw.cn:13000/kathy589285700 http://xcfw.cn
https://revenu.live/@gabriellaamar?page=about https://revenu.live/@gabriellaamar?page=about
http://test-www.writebug.com:3000/dyanchristman http://test-www.writebug.com/
https://bernard-guericolas.eu/index.php?action=profile;u=70331 bernard-guericolas.eu
https://git.jzxer.cn/danaekesteven git.jzxer.cn
https://quickdate.click/@felipaafk18201 https://quickdate.click
https://vydiio.com/@hbldebora09910?page=about https://vydiio.com/@hbldebora09910?page=about
https://alelo.org/@swennason0328 alelo.org
https://code.lefou.at/raulstrader530 https://code.lefou.at/
https://meeting2up.it/@franziskafob97 https://meeting2up.it/@franziskafob97
https://git.winscloud.net/pennigrasser9 git.winscloud.net
http://dev-gitlab.dev.sww.com.cn/francinebuckne http://dev-gitlab.dev.sww.com.cn
https://loveis.app/@maurinepotter0 loveis.app
https://crossy.video/@corazonwestall?page=about https://crossy.video/@corazonwestall?page=about
https://vidspaceaiapp.com/@shennahildebra?page=about https://vidspaceaiapp.com
https://git.mikspec.pl/layla70u924601 https://git.mikspec.pl/
https://gitea.freeyoursystem.de/jennihincks70 https://gitea.freeyoursystem.de/jennihincks70
https://www.streemie.com/@brittnymcalexa?page=about https://www.streemie.com/@brittnymcalexa?page=about
https://tubex.su/@mireyagairdner?page=about tubex.su
https://duanju.meiwang360.com/bettinamadera4 https://duanju.meiwang360.com
https://645123.com/@joeannagm42153?page=about 645123.com
Спасибо за лёгкость в общении! На все мои вопросы ответили быстро и подробно. Чувствуется, что вы действительно хотите помочь клиенту.
<a href=https://chesskomi.borda.ru/?1-8-0-00004521-000-0-0-1756714842>розы в Томске</a>
Прекрасные ранункулюсы!Пушистые облачка!
<a href=https://cah.forum24.ru/?1-13-0-00002580-000-0-0-1756376478>розы томск</a>
Удобная химчистка дивана на дому! Не пришлось никуда везти!
<a href=https://remont-uborka.ru/>химчистка дивана на дому</a>
Химчистка дивана на дому прошла успешно! Мебель сохранила свой вид!
<a href=https://uborka-26.ru/>озонирование</a>
Ваши советы по уходу в сторис помогли сохранить розы на День матери до трех недель!
<a href=https://t.me/cvetaevatomskru/344>заказать цветы томск</a>
Ваши розы – это классика, которая никогда не подводит. Идеальный выбор для любого торжества и для любого настроения.
<a href=https://aqvakr.forum24.ru/?1-7-0-00013765-000-0-0-1756885953>51 роза томск купить</a>
Ваши советы по выбору размера букета в соцсетях помогли не ошибиться с подарком для начальницы на юбилей!
<a href=https://www.instagram.com/reel/DGqJWhdSxfV/?igsh=Y3JyZnIxZ285YjF0>гипсофилы цена букета</a>
Ни одного увядшего лепестка! Все розы были идеальны. Видно, что за продукцией следят и доставляют её в лучшем виде.
<a href=https://automobilist.forum24.ru/?1-5-0-00001685-000-0-0-1756886104>купить букет роз томск</a>
Озонирование гардеробной! Исчез запах затхлости!
<a href=https://remont-uborka.ru/>Чистка деревянных расчесок и щеток для волос</a>
Спасибо за возможность заказать цветы поздно вечером. Это настоящая палочка-выручалочка для забывчивых романтиков вроде меня.
<a href=https://superogorod.ucoz.org/forum/2-4256-1>розы в Томске</a>
Уборка офисов в нерабочее время! Проявили уважение к нашему графику!
<a href=https://remont-uborka.ru/>стирка ковров</a>
Ваши советы по уходу в соцсетях продлили жизнь новогоднему букету до старого Нового года!
<a href=https://vk.com/wall-61709230_7284>букет пионов</a>
Изумительные композиции с ягодами!Ярко!
<a href=https://cah.forum24.ru/?1-13-0-00002603-000-0-0-1756470315>доставка цветов в томске</a>
Ваши видео с отзывами в инстаграм такие искренние! Заказала такие же розы на юбилей родителей - все гости восхищались!
<a href=https://t.me/cvetaevatomskru/488>заказать цветы с доставкой в томске</a>
Стирка одежды с выведением пятен удалась! Сложные загрязнения устранены!
<a href=https://uborka-26.ru/>сухая и влажная уборка</a>